Application Note 点状核マーカーの定量によるDNA損傷の評価
- DNA損傷マーカーの簡易定量のために、あらかじめ構成されたソフトウェアモジュールを使用
- 共焦点イメージングを用いて、個々の点状構造(puncta)を正確にカウント
- DNA損傷のメカニズムを解明するために、2つのマーカーの共局在を測定
PDF版(英語)
はじめに
DNAや生物製剤の損傷は、遺伝子の突然変異、癌、老化などに関与するため、生物学においてますます注目される分野となっています。DNAの損傷は自然に起こることもあれば、電離放射線、環境毒素、化学毒素への曝露の結果として起こることもあります。ある化合物の遺伝毒性の作用機序を同定し、特徴づけるために使用できるin vitroアッセイがいくつかあります。histone H2AXのserine139上でのリン酸化は、DNA二本鎖切断の早期かつ高感度な指標であることが示されています。また、DNA修復を調整する癌抑制タンパク質53BP1が、DNA損傷に応答してリン酸化され、核病巣を形成することも認められています *1。
本研究では、リン酸化されたhistone H2AXと53BP1の免疫蛍光検出に基づいて、化合物のDNA損傷を刺激する能力を評価するための3色自動ハイコンテントイメージングを開発しました。DNA損傷のレベルは、対照群とMitomycin C(MMC)、過酸化水素(H2O2)またはエトポシドで処理した細胞との間で比較されました。
メリット
- DNA損傷マーカーの簡易定量のために、あらかじめ構成されたソフトウェアモジュールを使用
- 共焦点イメージングを用いて、個々の点状構造(puncta)を正確にカウント
- DNA損傷のメカニズムを解明するために、2つのマーカーの共局在を測定
DNA損傷を示す核内の点状構造を可視化
市販の試薬とImageXpress Microハイコンテントイメージングシステムを用いることで、不均一性の細胞集団においてもDNA損傷を可視化し、その特徴を明らかにすることができます。
H2AXおよび53BP1に対する一次抗体(EMD Millipore)を、蛍光標識した二次抗体(Life Technologies)で検出し、蛍光励起/発光プロファイルはそれぞれ495/519および640/680 nmとしました。これらの細胞の核内の点状構造を正確に検出するために、画像は通常高倍率(少なくとも40倍)で取得され、標準的なFITCおよびCy5フィルターセットを用いて検出されます。
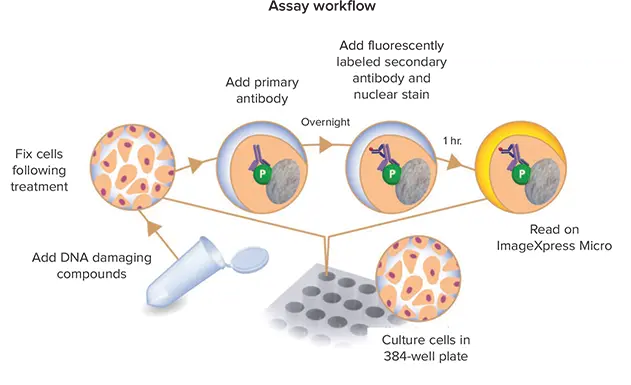
アッセイワークフロー
マルチパラメーターDNA損傷アッセイのワークフローは以下の通りです:
- 384ウェル黒壁透明薄底ポリスチレンマイクロプレートに5000~7500細胞/ウェルで細胞を播種する。
- U20S細胞またはCHO細胞を37℃で一晩培養します。
- MMCまたはエトポシドの連続希釈液で細胞を24時間処理するか、過酸化水素(H2O2)の連続希釈液で細胞を2時間処理します。
- 培地を交換し、細胞を37℃で30分間回復させた後、4%ホルムアルデヒドで室温で20分間固定します。
- PBSで細胞を洗浄し、室温で1時間細胞をブロックし、透過処理します。
- 一次抗体、抗H2AX抗体と抗53BP1抗体を加え、4℃で一晩インキュベートします。
- 1x PBSで3回洗浄します。
- 蛍光標識二次抗体を添加し、室温で1時間インキュベートします。
- 16 µM Hoechst 33342核染色液(最終濃度)を添加し、室温でさらに15分間インキュベートします。
- 細胞を1x PBSで3回洗浄します。
- 3つの波長で画像を取得します。
- 画像解析を行います。
DNA損傷は、次のセクションで最も複雑でないものから順に説明する3つの異なる方法を用いて定量しました。
損傷した細胞核を識別するために、シンプルなセルスコアリング解析を使用
設定済みのMetaXpress®ソフトウェア・アプリケーション・モジュールであるセル・スコアリングにより、核をDNA損傷マーカーに対して陽性または陰性に分類し、DNA損傷を示す細胞の割合を計算することができます。ワイドフィールドモードで10倍の対物レンズで1部位をイメージングすれば十分なことが多いため、画像取得と解析は迅速に行うことができます(図1)。単一の視野で、最高濃度の化合物では500個を超える細胞が得られ、マイトマイシンC(MMC)の毒性濃度以下のウェルでは2800個を超える細胞が得られました。

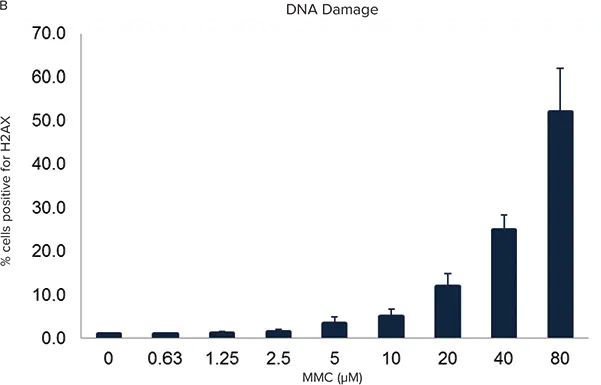
図1. MMC(DNA複製阻害剤)24時間処理後のU2OS細胞のDNA損傷反応。核を10倍に拡大して画像化し、二本鎖切断マーカーであるphospho-H2AX Aに対して陽性または陰性としてスコア化しました。上:染色された核はすべて擬似的に紫色に着色され、H2AX陽性核は緑色で示されます。下:健全な核を赤色、DNA損傷核を緑色で示したセグメンテーションマスク。B. MMC濃度に対するH2AX陽性細胞の割合を示す用量反応のプロット。
共焦点顕微鏡を用いて、個々の核内点状構造のカウント精度を向上
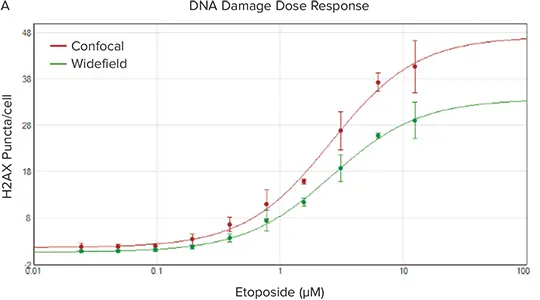
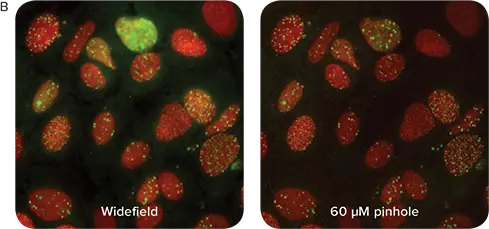
個々のマーカーの点状染色は、細胞ごとあるいはウェルごとの数、平均強度、総面積、総強度などいくつかのパラメーターで特徴づけることができます。この実験では、ワイドフィールドモードまたは60µmピンホールコンフォーカルモードのいずれかを使用して、ImageXpress® Micro Confocalシステムで各ウェルの複数の画像を取得しました。両モードともイメージングには40X Plan Apo対物レンズを用いました。画像は、核内の点状構造を特異的にカウントする簡単なユーザー設定のMetaXpress®ソフトウェアモジュールで解析しました。共焦点イメージングは面外の対物レンズからの蛍光を拒絶するので、点状構造が明瞭に識別できる形で現れ(図2B)、より容易にセグメンテーションされます。その結果、共焦点光学系を使用して生成された画像は、個々の点状構造をより正確にカウントすることができ、その結果、より大きなダイナミックレンジ(Signal/Background)と高いZ' factorによって定義されるように、よりロバストなアッセイが可能になることが示されました(図2)。
| 測定パラメータ | Signal/Background | Z' Factor | ||
|---|---|---|---|---|
| ワイドフィールド | コンフォーカル | ワイドフィールド | コンフォーカル | |
| 点状構造数
(H2AX) |
2.6 | 8.3 | 0.17 | 0.57 |
|
点状構造面積 細胞(H2AX) |
10.2 | 19.6 | 0.42 | 0.54 |
図2. A. 共焦点(赤)イメージングとワイドフィールド(緑)イメージングを用いて、エトポシド処理に対するDNA損傷応答を比較したグラフ。細胞あたりのH2AX染色点刻数をプロットしました。B. 40X PA (0.95NA)対物レンズを用い、ワイドフィールドイメージング(左)と比較した共焦点モード(右)の画像は、核の点刻の視認性が向上し、バックグラウンド蛍光が減少していることを示します。C. 共焦点画像は、表に示した高いSB比と高い z’ factorsに反映されるように、よりロバスト性の高いアッセイをもたらしました。
2つのマーカーの共局在を測定
2つの異なるDNA損傷マーカーの共局在を評価することで、化合物の核毒性メカニズムに関与する生物製剤の経路について重要な洞察を得ることができます。修復タンパク質である53BP1の存在は、先に紹介した二本鎖DNA切断のマーカー(H2AXマーカー陽性細胞の割合、細胞あたりの点状構造カウント/高輝度/存在面積)の測定とともに、ユーザーが設定したソフトウェア解析モジュールと高倍率共焦点画像(図3)を組み合わせて、細胞と対応するウェルの共局在化値を生成することで計算できます(図4)。
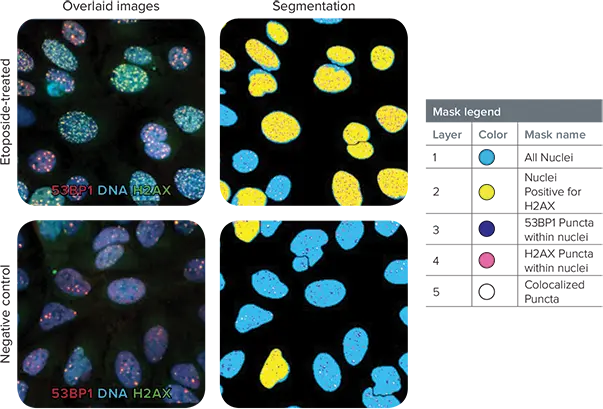
***図3. 共焦点画像から、エトポシド処理に反応して共局在化した点状構造が明らかになりました。
左は擬似カラー40倍オーバーレイ(青色=ヘキスト核、赤色=抗53BP1、緑色=抗H2AX、共局在した赤色と緑色のマーカーは黄色に見える)、右は得られたセグメンテーションマスク(凡例参照)。
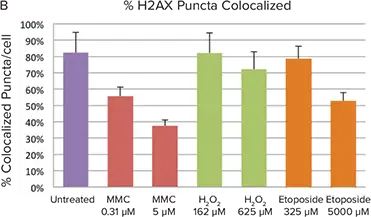
図4. 処理細胞におけるDNA損傷反応と対照細胞の比較。A. 未処理細胞では、H2AX点状構造の検出によって測定される核DNA損傷量は少なく、既知のDNA損傷化合物であるマイトマイシンC(MMC)、過酸化水素(H2O2)、エトポシドの添加によって増加します。B. 未処理細胞ではH2AXと53BP1の点状構造の共局在は80%以上ですが、MMCで処理した細胞では53BP1よりもH2AXの点状構造数が有意に多いため、共局在の割合は低く見えます。H2AXと共局在する53BP1の量から、DNA損傷のメカニズムとDNA修復の段階を知ることができます。
サマリー
ImageXpress®Micro Confocalシステムまたはワイドフィールドシステムを用いたH2AXと53BP1の高感度マルチプレックスアッセイにより、DNA損傷の定量を目的としたハイスループットなスクリーニングが可能になることを示しました。従来、核マーカーの共局在を測定する必要があるアッセイでは、共焦点画像は個々の点状構造をより正確に同定するために利用されてきました。これは私達の実験にも反映されており、ワイドフィールド画像の解析から得られたz’ factorは0.5未満であったのに対し、共焦点モードで得られた画像は許容できるアッセイのロバスト性を示しました。さらに、DNA損傷の様々なメカニズムを研究するために蛍光標識マーカーをマルチプレックスする能力は、細胞、試薬、時間を最も効率的に使用することを可能にします。
参考文献
- Monika Podhorecka, Andrzej Skladanowski, and Przemyslaw Bozko, "H2AX Phosphorylation: Its Role in DNA Damage Response and Cancer Therapy," Journal of Nucleic Acids, vol. 2010, Article ID 920161, 9 pages, 2010.
PDF版(英語)