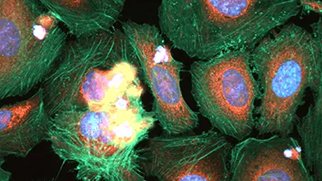
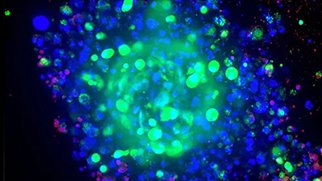
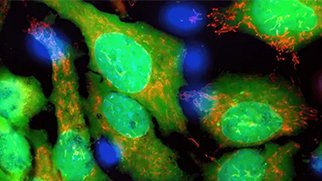
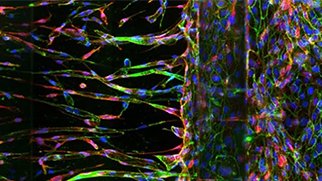
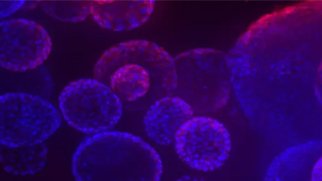
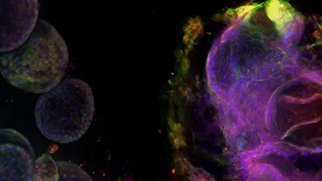
がんスフェロイドの3Dイメージング技術の利点
がんは、細胞が正常な限度を無視して増殖・分裂し、隣接組織に侵入して破壊して、最終的には体内の離れた部位に転移する変化を伴います。がん研究では、がん細胞とその環境との間の複雑で、不可解な相互作用を研究し、治療介入のポイントを特定するためのツールが必要です。
腫瘍や臓器の生体内環境をシミュレートするためのスフェロイドやオルガノイド、オルガン・オンチップ・システムなどの3D細胞モデルは、がん研究を促進します。これらの3D細胞モデルの解析に、当社のハイコンテント・イメージングシステムと解析ソフトウェアソリューションが活用できます。
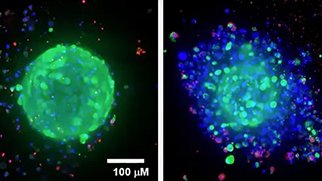
がんスフェロイドの3Dイメージング技術の利点
がんスフェロイドは、標準的な2D細胞培養よりもはるかに効果的に腫瘍の挙動を模倣します。このような3Dスフェロイド・モデルは、潜在的ながん治療薬を同定するためのスクリーニング環境において効果的に使用されています。これらの培養系は、さまざまな生物学的出力を定量化するためのマルチパラメトリー分析に使用することができ、がん治療薬の開発を加速します。
主なメリット:
- 3Dハイコンテントイメージングにより、適切で正確な試験が可能
- 3D培養システムによって制作されたヒトがん細胞スフェロイドをハイスループット形式で使用することで、抗がん剤開発を加速させることができます
- がん細胞の共焦点3D画像解析を用いた研究により、マルチパラメトリックな特性評価が可能になります
スフェロイドは96ウェルあるいは384ウェルプレートで培養し、化合物で処理します。そして働いている細胞プロセスや経路を明らかにする色素で染色することができます。場合によっては、スフェロイドは洗浄することなくイメージングすることができ、必要に応じて固定することもできます。
幅広いイメージング、細胞スクリーニング、マイクロプレートリーダーシステムにより、腫瘍学のワークフローを簡素化します。
ハイスループット・スクリーニング環境における
3Dがんスフェロイド解析のワークフロー
スフェロイドは96ウェルあるいは384ウェルプレートで培養し、化合物で処理し、働いている細胞プロセスや経路を明らかにする色素で染色することができます。場合によっては、スフェロイドは洗浄することなくイメージングすることができ、必要に応じて固定することもできます。
幅広いイメージング、細胞スクリーニング、マイクロプレートリーダーシステムにより、腫瘍学のワークフローを簡素化します。
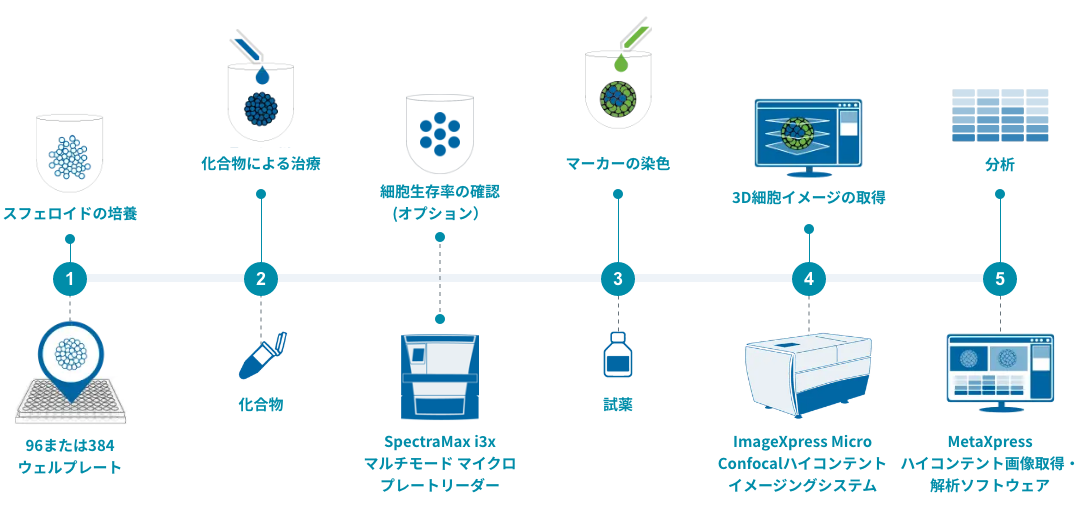
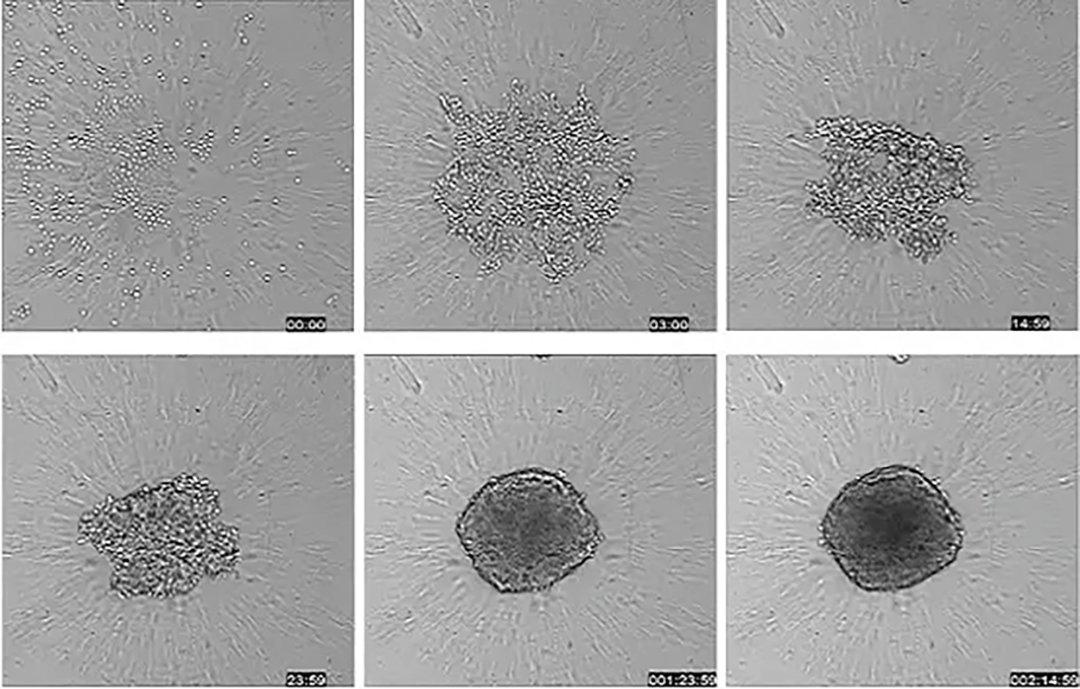
このワークフローは、スフェロイドを分析するための簡略化されたプロセスを示し、研究を合理化し、スループットを向上させるのに役立つシステムを紹介しています。
・スフェロイドの培養
がん細胞は、ULA(ウルトラ・ロー・アタッチメント)や丸底プレートなどで直接培養し、スフェロイドの典型的な形態を発達させることができます。一つのウェルで複数のスフェロイドを培養することも可能です。
・化合物による処理
スフェロイド形成後、目的の濃度の化合物をウェルに添加し、研究するメカニズムに応じて、1~数日間インキュベートします。
・マーカーの染色
化合物処理終了後、染色液を培地に直接添加します。必要であれば、オートメーション装置でスフェロイドを注意深く洗浄することも可能です。
・スフェロイド画像の取得
スフェロイド本体内の画像は、専用のイメージング装置を使用して、個別に、またはZ-スタック画像(異なる深度で撮影された複数の画像)として取得することができます。
・がん細胞の解析
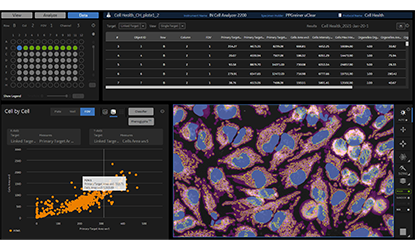
細胞イメージング解析ソフトウェアを使用して、細胞画像の定量解析を実行し、さまざまなマーカーの発現をモニターして生物学のリードアウトを定量化します。
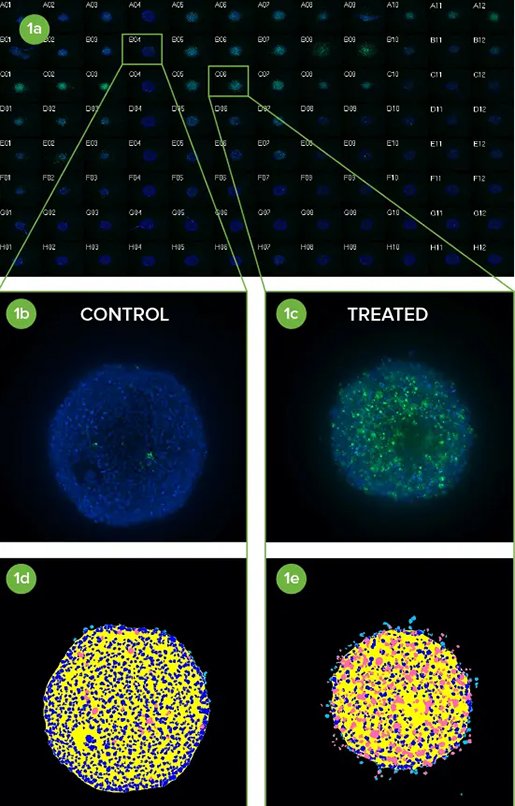
がん治療薬のスクリーニングのためのスフェロイドの高スループット共焦点イメージング
スフェロイドの高スループット共焦点イメージング
近年、in vivo組織環境のモデルとして使用する腫瘍細胞のin vitro凝集体の開発が大きく進展しています。低付着性真円底マイクロプレートのウェルに播種すると、これらの凝集体は個別のスフェロイドを形成します。スフェロイドは、腫瘍と同様に、表面に露出した細胞と深く埋もれた細胞、増殖細胞と非増殖細胞、低酸素状態の中心部と、十分に酸素化された外側の細胞層の両方を含むため、通常の2D細胞培養よりも腫瘍の挙動をより効果的に模倣できると考えられています。このような3Dスフェロイド・モデルは、潜在的ながん治療薬を同定するためのスクリーニング環境として効果的に利用されています。
ロバスト性スフェロイドアッセイの開発にはいくつかの課題があります。化学療法薬候補のより適切な試験を促進するのに重要なのは、自動ハイスループット、ハイコンテントイメージングを使用することです。
- 20倍の倍率でスフェロイド全体を1視野でキャプチャー
- 96または384ウェルフォーマットで生物学的に関連性の高い3Dスフェロイドをスクリーニング
- 共焦点イメージングを使用して細胞応答を正確に検出
- z平面画像の2D再構成のみを保存することで、ストレージ容量を節約