Application Note CHO細胞におけるIgG生産の自動最適化
PDF版(英語)
はじめに
Michael Kowalski、スタッフアプリケーションサイエンティスト|Beckman Coulter Life Sciences、インディアナポリス
David Apiyo、マーケティングアプリケーションマネージャー| Pall ForteBio、カリフォルニア州フリーモント
Rashi Takkar、プロダクトマネージャー| Pall ForteBio、カリフォルニア州フリーモント
Tara Jones-Roe, マーケティングマネージャー| Beckman Coulter Life Sciences, インディアナポリス

モノクローナル抗体は長い間、細胞や分子のアッセイに不可欠なツールであり、低分子から生物学的疾患治療へのシフトの一環として、臨床へと移行してきました。抗体は通常、タンパク質が望ましい翻訳後修飾、標的特異性、親和性を持ち、比較的高いレベルで発現するようにスクリーニングされた細胞株から生産されます。一旦この生産株が同定されれば、細胞増殖やタンパク質生産を増加させるために培地を最適化することにより、より高い力価を達成することができます。
おそらくタンパク質産生のための最も一般的な細胞はチャイニーズハムスター卵巣(CHO)細胞であり、これは接着培養または懸濁培養で増殖することができ、後者の方が単位培地あたりの細胞数が多く、バイオリアクターでの培養が可能です。CHO細胞を培養するための "最適化された "培地が数多く市販されているが、発現クローンごとに、タンパク質産生を最大化する条件が異なるため、これらの培地は最適でない可能性があります。
培地最適化の理想的なアプローチは、様々な培地成分を異なる濃度で互いに組み合わせて試験する、要因実験計画法(DOE)を用いることです。しかし、このような要因実験は、試験を必要とする条件の数を急速に増加させます。IgGや他のタンパク質の生産を定量化する一般的な方法は、特にDOEに必要な高スループットでは、手間がかかる(ELISAなど)か、法外に時間がかかる(HPLCなど)ことが多いです。対照的に、Octetプラットフォーム(Pall ForteBio、図1)は、定量化または速度論的解析の手段として、分子の結合をリアルタイムで検出するBio-Layer Interferometryを使用しています。このテクノロジーでは、オプションの希釈ステップ以外のサンプル前処理は基本的に不要であり、高スループットモデルでは最大96サンプルを同時に処理できます。



図1. 自動 IgG 最適化。Biomek FXP Workstation (A) で培地サプリメントのファクトリアル・コンビネーションを作成し、Octet HTX システム (B) で CHO 細胞の IgG 力価を分析しました。SpectraMax i3x マルチモードマイクロプレートリーダー with SpectraMax MiniMax 300 イメージングサイトメーターで細胞数とXTT吸光度を測定しました(C)
ここでは、このハイスループットIgG分析とBiomek FXP自動ワークステーション(図1)を組み合わせることで、CHO細胞株におけるIgG発現のDOE最適化がどのように可能になったかを示します。Biomek FXP Workstation は、96 種類の培地組み合わせの調製と複製条件での細胞のプレート化、Octet HTX システム用のサンプルプレートと試薬プレートの作成、CHO 細胞増殖に対する培地成分の影響をよりよく理解するための XTT アッセイの開始に使用されました。
概要
- 培地成分の実験計画(DOE)最適化により、IgG生産量を50%増加
Biomek FX P Workstationで96培地条件の作成、細胞プレーティング、アッセイ調製を自動化。
Octet ® HTXシステムを用いて、384ウェル中のIgG力価を20分以内に分析 - 細胞増殖によるIgG増加を促進する因子を特定
SpectraMax MiniMax 300イメージングサイトメーターで細胞をイメージング
SpectraMax i3x マルチモードマイクロプレートリーダーを用いた自動XTTアッセイと解析
材料と方法
CHO細胞培養
CHO DP-12クローン#1934(ATCC)は、インターロイキン8に対する組換えヒトIgG1抗体を安定に発現するCHO株です。CHO細胞は、DMEM+GlutaMAX(Thermo Fisher)、10%ウシ胎児血清(Thermo Fisher)、2μg/mL組換えヒトインスリン(Sigma)、0.1%微量元素AおよびB(Corning)、および200nMメトトレキサート(Sigma)を用いて接着条件下で維持しました。細胞は37℃、5% CO2で培養しました。
DOEメディアの最適化
最適化実験の基礎培地はCD OptiCHO(Thermo Fisher)でした。OptiCHO中で継代を繰り返すと、細胞は懸濁状態で増殖したが、最初のプレーティングでは接着性を維持しました。この接着性により、画像ベースの細胞計数が可能になり、IgG分析のための培地サンプリング中の細胞移動を防ぐことができました。
IgG産生増強のために試験した追加成分には、ポリアミン、SPITE、MEM非必須アミノ酸溶液、バイオリアクターpH調整溶液(「バイオリアクターバッファー」、すべてSigma Aldrich製)、GlutaMAX、HEPES、CHO CD EfficientFeed A(すべてThermo Fisher製)が含まれます。
Span-8ピペッターとEST(enhanced selective tip)機能付き96チャンネルヘッドを備えたBiomek FXPワークステーションを使用して、培地成分の階乗の組み合わせを作成しました(ワークフローは図2を参照)。EST機能により、マルチチャンネルヘッドに任意のチップの組み合わせが可能になり、4、16、48ウェルのセットを一度にスタンプする際の要因論的アプローチに役立ちました。Biomek ワークステーションは、操作中の細胞培養の無菌性を維持するため、HEPAフィルター付きのエンクロージャー内に設置されました。
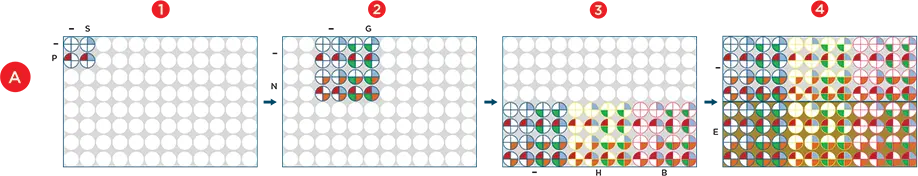
図2. 自動化されたファクトリアルアプローチ。A) Span-8ピペッターを使用して、すべてのステップでディープウェルプレートに試薬を分注し、enhanced selective tipマルチチャンネルポッドを使用して、4、16、または48ウェルの前に結合した試薬を新たにプレートされた試薬にスタンプしました。2)培地(-)、GlutaMAX(G)およびNEAA(N)を16ウェルに組み合わせ、Polyamine/SPITEウェルを4ウェルにスタンプしました。3) 培地(-)、HEPES(-)およびバイオリアクターバッファー(B)をそれぞれ16ウェルに分注し、16混合ウェルを各試薬に分注しました。4) 培地(-)とEfficient Feed A(E)を2枚目のプレートの48ウェルに分注し、それぞれ48個の混合ウェルをスタンプしました。B) 最終96条件を384ウェルプレートに四重反復でプレー トし、各条件に細胞を添加しました。青く着色したウェルは、Polyamine、SPITE、GlutaMAX、NEAA、HEPES、EfficientFeed Aを添加した四重反復ウェルを示します。
得られた96条件を、384ウェル透明底プレートの4重ウェルにプレーティングしました。40,000個のCHO細胞が各ウェルにプレーティングされ、総容量は100μL/ウェルとなりました。培地の組み合わせと細胞のプレーティングは20分で完了しました。細胞を37℃、5% CO2で2-4日間培養した後、IgGおよび増殖解析を行いました。
IgG定量
IgGの定量には、Biomek FXP Workstationを用い、50μLの細胞培地を培養プレートから384ウェル黒色傾斜底プレート(Pall ForteBio)に移しました。次に、培地から直接IgGを結合させるため、Protein A Dip and Read™ Biosensorを使用し、Octet HTXシステムでサンプルを分析しました。プローブはまずベースOptiCHO培地で水和され、4重ウェル間で10mMグリシン、pH1.7で再生され、ベースOptiCHO培地で中和されました。水和と再生/中和プレートもBiomek FXP Workstationで調製しました。全自動プロセスは7分以内で完了し、96個のバイオセンサーを使用した場合、Octet HTXシステムで384検体の処理は20分以内で完了しました。
700μg/mLのプロテインAキャリブレーター(Pall ForteBio)をOptiCHOで0~50μg/mLの範囲に連続希釈し、プロテインAバイオセンサーを用いて3連ウェルをアッセイしました。標準曲線は、結合率アルゴリズムの初期勾配と、サンプルウェルからの反応を計算するための5パラメータロジスティック曲線(重み付けY2)を使用して、これらのキャリブレーターで作成されました。サンプルウェルの培地構成が異なるため、各培地添加物がIgGシグナルまたはベースラインに有意な影響を及ぼさないことを確認するために、キャリブレーターを用いて各培地添加物を試験しました。
細胞成長分析
最初のプレーティングとIgG分析のためのサンプリング前に、SpectraMax i3x マルチモードマイクロプレートリーダーとSpectraMax MiniMax 300 イメージングサイトメーターを用いて培養プレートを画像化しました(図1)。ウェルあたり1枚の明視野画像を取得し、StainFree Cell Detection Technologyを使用し、CellsC設定を使用して細胞を計数しました。
異なる培地条件下でのCHO細胞コロニーの形態変化は細胞数に影響を与える可能性があるため、XTTアッセイで細胞増殖結果を検証しようとしました。IgG分析のための培地サンプリング後、Biomek FXP Workstationは15μLのXTT試薬(Cell Signaling)を細胞に添加し、培養プレートを37℃に戻しました。SpectraMax i3x マルチモードマイクロプレートリーダーで、1~4時間のインキュベーション後、475 nmおよび660 nmの吸光度を測定しました。
データ分析
再現値を平均し、Design-Expert 8.0.2 ソフトウェア(Stat-Ease)にインポートして、単独または互いに組み合わせて、細胞増殖またはIgG産生に有意な影響を及ぼす因子を同定しました。さらに、Design-Expert を用いて、IgG 産生を最大化する条件を予測しました。
結果
この最適化アプローチの主な目的は、最高レベルの IgG産生を促進する条件を決定することでした。しかしながら、IgG産生量の増加は、細胞あたりの産生量を増加させること、および/または細胞増殖を促進することによって達成することができます。従って、これらの効果を区別するために、細胞増殖とIgG力価の両方を分析しました。
プレーティング30分後のプレートの画像解析により、プレート全体で一貫した細胞数(CV = 6.1%)が確認され、検出されたいかなる差異も培地組成によるものであることが確認されました。図3は、96種類の培地条件下で4日間培養した後のIgG力価の定量を示します。IgG濃度測定における1つの交絡因子は、蒸発によってプレート端のウェルの容量が減少することでした。最も外れ値の高かった2つのウェル(図3C)は、いずれもコーナーウェルで、エッジウェルを用いた4重反復は、内部4重反復(2.9%)よりもCVがはるかに高かったです(9.6%)。この影響が非常に大きかったため、外側のウェルは計算から除外しました。その結果、平均力価は7.8~14.6μg/mLで、ベースとなるOptiCHO培地では8.8μg/mLのIgGが得られました。これは、1回の培地最適化で、IgG産生を66%向上させる条件を特定できたことを示しています。
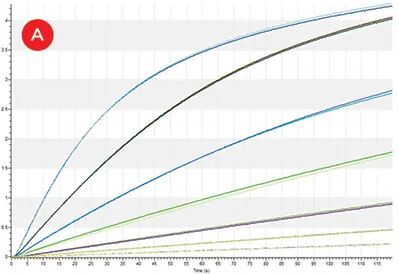
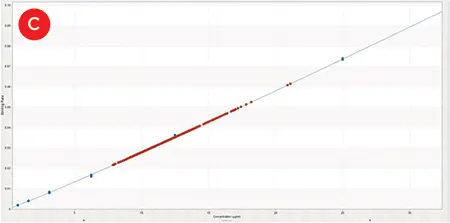
図3. IgG 力価。A) Octet HTX上のプロテインAバイオセンサーで測定したプロテインAキャリブレーター(50-0.78 μg/mL)の1:2希釈液の反復結合曲線。B) 96種類の各成長条件の1レプリケートから得られたIgG分子のプロテインAバイオセンサー結合曲線。C) キャリブレーター曲線(青、0~25 μg/mL)上にプロットした全384サンプルのIgG濃度(オレンジ)
統計的デザインソフトウェアを用いて、IgG力価に有意な影響を及ぼした因子を、単独または他の因子と組み合わせて同定しました(表1)。単独では、PolyamineとGlutaMAXはIgG産生を増加させ、バイオリアクターバッファーは産生を減少させ、SPITE、HEPES、EfficientFeed Aは無視できるほどの影響を及ぼさなかったです。しかし、図4は、SPITEがGlutaMAXおよびバイオリアクターバッファーの両方と有意な相互作用を示したことを示しています。SPITEは、バッファーなしの条件下ではGlutaMAXのプラス効果を実際に減少させましたが(図4A)、SPITEとバイオリアクターバッファーの組み合わせは有意なプラス効果を示し(図4B)、3因子すべての組み合わせによって最高のIgG産生が達成されました(図4C)。各因子を単独でアッセイした場合、SPITEもバイオリアクターバッファーも前進しなかったでしょうから、これは要因分析の利点を示しています。
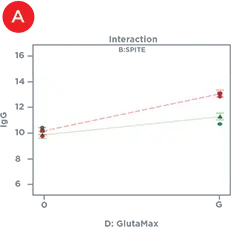
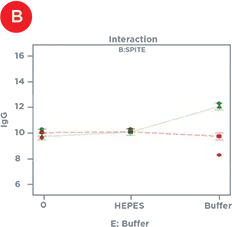
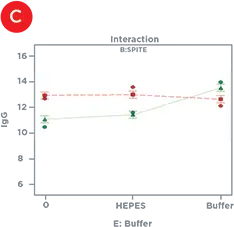
図4. サプリメントの相互作用。A) IgG力価に対するGlutaMAXの正の効果(赤線)は、SPITE(緑線)の存在により減少します。B) SPITE(緑線)は、バイオリアクターバッファーの存在下でのみIgG力価を増加させます。C) SPITE(緑線)は、バイオリアクターバッファー存在下でGlutaMAX IgG力価(赤線)を増強します。この条件は、要因分析法がなければ見逃されていた可能性が高いです。
IgG増加の潜在的な機序を調べるため、統計デザインソフトを用いて、細胞増殖に対するサプリメントの影響を分析しました。その結果、GlutaMAXとSPITEは、SpectraMax MiniMaxサイトメーターの細胞数を個々に有意に増加させ、EfficientFeed Aは細胞数を減少させましたが、組み合わせるとより大きな効果を示しました(表1)。図5は、OptiCHO培地ではCHO細胞が主に3Dクラスターで増殖したことを示しています。GlutaMAXはコロニーの大きさを増加させるようですが、SPITEはコロニーの形態を変化させ、コロニー間で増殖する個々の細胞の数を増加させるようです。細胞コロニーは3D的な性質を持つため、細胞数の変化はイメージングでは過小または過大に報告される可能性があり、そのため相対的な細胞数を定量化する追加手段としてXTTアッセイを利用しました。
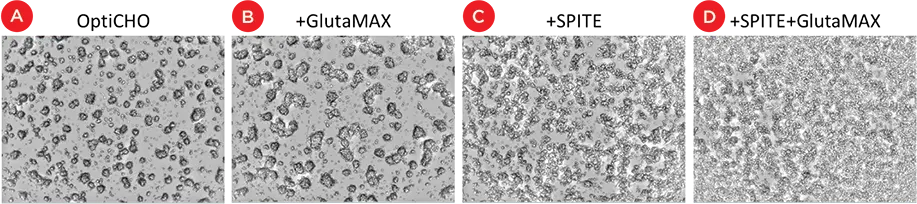
図5. 細胞増殖に対するサプリメントの効果。ベースOptiCHO培地中のCHO細胞コロニーを示すSpectraMax MiniMaxサイトメーターの画像(A)。(B)GlutaMAXの存在によりCHOコロニーのサイズが増大し、SPITEの添加によりコロニー間の細胞数が増加しました(C)。SPITEとGlutaMAXを併用すると、どちらか一方の添加剤単独よりも多くの細胞が得られます(D)
ここでも、エッジウェルでの蒸発の影響を避けるため、XTT分析には内部ウェルのみを使用しました。細胞イメージングで見た結果と同様に、GlutaMAXは有意なプラスの効果を示しましたが、SPITEはバイオリアクターバッファー存在下でのみXTT吸光度を増加させました。GlutaMAXの効果もバイオリアクターバッファー存在下で増加しました。興味深いことに、Efficient Feeder AはXTT吸光度にプラスの効果を示しましたが、この効果はSPITEの存在によって中和されました。最後に、HEPESはXTTシグナルにマイナスの影響を与えることが示されました(表1)。培地の違いがXTTの結果を混乱させる可能性もありますが(すなわち、緩衝液/pHが反応化学に影響する可能性があります)、GlutaMAX添加のような条件では、イメージング結果が補強されたことで、細胞への影響のより強力な証拠が得られました。
表1:IgG力価および細胞増殖に対するサプリメントの効果。
| IgG 力価 | 細胞数 | XTT | |
|---|---|---|---|
| ポリアミン | + | ||
| SPITE | |||
| NEAA | |||
| GlutaMAX | + | + | + |
| バイオリアクターバッファー | - | + | |
| エフィシエントフィードA | - | + | |
| SPITE+GlutaMAX | - | + | |
| SPITE+バッファー | + | + | |
| SPITE+エフィシエントフィードA | - | ||
| GlutaMAX+バイオリアクターバッファー | + |
増加は「+」記号、減少は「-」記号、無記号は効果がないことを示します。
最後に、IgG発現に最適な条件を予測するため、統計的デザインソフトを使い、96点のデータからモデルを作成しました。このモデル化により、1回の実験で最高濃度を示した条件を単純に採用することで、事実上の最適条件として「偽陽性」を利用する可能性を減らすことができます。このモデルに基づき、ポリアミン、SPITE、GlutaMAX、およびバイオリアクターpH調整液を添加した培地では、13.6μg/mLのIgGが生成されると予測され、ベースとなるOptiCHO培地での9.6μg/mLの生成予測よりも42%増加しました。

図6. ハイスループットタンパク質分析システム。Octet HTX システムと SpectraMax i3x マルチモードマイクロプレートリーダー(SpectraMax MiniMax サイトメーター付き)を、Biomek FXP ワークステーション、ストレージ、インキュベーターとどのように統合し、ハイスループットのサンプル処理と解析を可能にするかを示す 3D レンダリング。Octetの結果は、Biomek FXP Workstation上でその後のリキッドハンドリングステップ(クローンヒットの拡大など)を介入なしに行うことができます。
ディスカッション
ここでは、培地の最適化によってCHO細胞の増殖とタンパク質生産がどのように改善されるかを示しました。要因実験計画を利用することで、CHO培養に最適化された市販培地よりも抗体価を42-66%向上させる条件を特定することができました。また、発現を促進しない因子を同定し、培地にこれらのサプリメントを含めないことで、生産細胞培養のコストを削減することができました。すべてのサプリメントの組み合わせをテストすることで、サプリメントを単独でテストしたのでは同定されなかったであろうポジティブな組み合わせを同定することができました。しかし、このような因数分解の組み合わせは、手作業で達成するのは困難です。この実験では、シングルピペットと8チャンネルピペットを組み合わせて184回の手作業による移動が必要でした。自動化は、このアプローチにおけるエラーの可能性を減らすだけでなく、科学者がベンチでこれらのステップを実行するのに費やす時間を、実験計画やデータ解析に費やすことができます。
IgG力価に加えて細胞増殖を分析することで、細胞増殖に主に影響する因子(GlutaMAX、SPITE)と、増殖に影響を与えずにIgG産生を促進する因子(ポリアミン)を区別することができました。この追加情報は、段階的添加が有益であることを示唆し、それによってまず細胞増殖が刺激され、次いでタンパク質産生に切り替わるでしょう。加えて、これら2つの作用の間にはバランスがあると考えられます。例えば、細胞増殖が多すぎるとIgG産生に利用できるエネルギーが減少するか、タンパク質産生に多くのエネルギーが割かれて細胞増殖が遅くなります。繰り返しになりますが、要因論的アプローチは、最適なバランスを提供する条件を特定する可能性が高いです。
このタイプのDOEアプローチを利用する際のもう一つの考慮点は、様々なサプリメントが分析に影響を与える可能性があることです。一例として、リノール酸/オレイン酸/アルブミンのサプリメント(Sigma Aldrich)を添加すると、細胞や標準物質がない場合でも、Octetの測定値のベースラインがシフトします。全てのウェルにこのサプリメントがあるわけではないので、これらのウェルにおけるIgG産生の正当な増加を偽陽性から識別することは困難であり、したがってこの試薬はスクリーニングに含まれなかったです。上述したように、異なる因子が接着細胞コロニーの特徴に影響を及ぼし、それがイメージング細胞数を歪め たり、XTT反応に影響を及ぼしたりする可能性もあ るので、作用機序を予測する際には複数の分析を行うことが有益です。
その他の交絡要因としては、先に述べたように、エッジウェルにおける蒸発効果があります。この影響を最小化する一つの方法は、より短い期間で調べることです。例えば、培養2日目のIgG力価の反復CVは、内側ウェルでは2.5%でしたのに対し、エッジウェルではわずか3.8%でした(4日目では9.6%)。しかし、培養時間が長ければ長いほど、培養時間が数週間に及ぶこともあるバイオリアクターに適した条件を特定できる可能性が高くなります。エッジ効果を最小化するオプションとしては、蒸発ウェルのあるプレートを利用すること、あるいは今回行ったように、エッジウェルの値を考慮から除外することなどがあります。Biomek FXP WorkstationのマルチチャンネルヘッドのEST機能を利用して、384ウェルプレートの308ウェルに試薬と細胞のみを添加し、残りの76ウェルに水を添加することもできます。EST機能により、各プレートに標準曲線用のウェルを残しておくこともできます。蒸発の影響を減らす最後の方法は、Biomek Span-8ピペッターの液面検知機能を利用して各ウェルの容量を計算し、分析前に容量を正規化することです。
Octet HTX システムは、サンプル調製が容易であり、サンプル処理も迅速であるため、発現クローンスクリーニングなどの高スループットアプリケーションに最適です。完全なハイスループットワークフローを可能にするために、Octet HTX システムを Biomek FXP ワークステーションに統合しました(図 6)。この構成により、タンパク質の定量やカイネティクス研究の直接ロード、処理、解析を自動化することができます。また、このシステムには、高発現クローンをより大きなウェルに拡大するなどの、追加のリキッドハンドリングステップを推進するために結果を利用する機能もあります。Biomek FXP ワークステーションのリキッドハンドリングパワーと Octet HTX システムを組み合わせることで、タンパク質生産最適化と解析の時間、労力、コストを最小化することができます。
SpectraMax i3xマルチモードマイクロプレートリーダーについて詳しくはこちら >>
PDF版(英語)