Application Note カルシウムフラックスアッセイで
神経毒性評価と創薬スクリーニング
- プライマリニューロン培養で細胞内カルシウムオシレーションをリアルタイムでモニタリング
- Peak Pro解析アルゴリズムを用いて化合物の効力を評価
- カルシウムオシレーションパターンの違いに基づいて化合物を比較
- ピーク頻度、振幅、曲線下面積などの詳細解析
PDF版(英語)
はじめに
Marcela Laukova, PhD and Michael P. Shakarjian, PhD|ニューヨーク医科大学健康科学・実践学部公衆衛生学科環境健康科学部門|ニューヨーク州ヴァルハラ
Cathy Olsen, PhD|Sr.アプリケーションサイエンティスト|モレキュラーデバイス
ニューロンは中枢神経系および末梢神経系に存在する電気的に興奮性の細胞であり、電気的および化学的シグナルを介して情報を処理・伝達します。これらのシグナルはシナプスを介して発生し、ニューロン同士が接続して神経ネットワークを形成します。
カルシウムイオンは哺乳類ニューロンにおける重要な細胞内メッセンジャーとして機能し、主要な神経機能を制御する多様な細胞内シグナルを生成します。シナプス前終末では、カルシウムの流入が神経伝達物質を含むシナプス小胞のエキソサイトーシスを引き起こし、シナプス後部では樹状突起スパインにおけるカルシウム濃度の一過性上昇が、活動依存性シナプス可塑性の誘導に不可欠です。細胞内カルシウムシグナルは、マイクロ秒単位の神経伝達物質放出から、数分から数時間にわたる遺伝子転写まで、広範な時間スケールで作動するプロセスを調節します。
細胞膜には複数のカルシウム透過性チャネルが存在します(例:電位依存性カルシウムチャネルや、NMDA、AMPA、ニコチン性アセチルコリン受容体を含むリガンド作動性チャネル)。これらは生理的条件下でニューロン細胞内のカルシウムフラックスを微調整します。異なる受容体やそのアゴニストが、この重要な神経機能調節因子を健康および疾患状態でどのように変化させるかを理解することは、主に神経毒性試験や創薬において、新規化学モジュレーターの開発に寄与します。
カルシウムイメージング、すなわち細胞内カルシウムの変化をモニタリングする技術は、ニューロン機能におけるカルシウムイオンの多様な役割を調べるために非常に有用です。ニューロンネットワーク内の動的なカルシウムフラックスを直接測定することで、ニューロンが細胞外空間からのシグナルをどのように処理するかを明らかにできます。例えば、神経伝達物質や薬理学的化合物の添加による細胞内カルシウム濃度変化への応答などです。
ここでは、EarlyTox™ 心毒性キットとFlexStation® 3 マルチモードマイクロプレートリーダーを組み合わせて、マイクロプレートフォーマットでラット初代皮質ニューロンの細胞内カルシウムフラックスを測定する方法を紹介します。このシステムは化合物のハンドリングを可能にし、カルシウム動態のリアルタイムモニタリングを実現します。SoftMax® Pro ソフトウェアは、より正確な神経毒性試験および創薬に必要なシグナルの定量化を提供します。さらに、SoftMax Proソフトウェア内のPeak Pro解析アルゴリズムでは、ピーク数、ピーク頻度、ピーク振幅、ピーク幅、ピーク立ち上がり時間、ピーク減衰時間、ピーク間隔など、さまざまなピーク属性を計算できます(図1)。
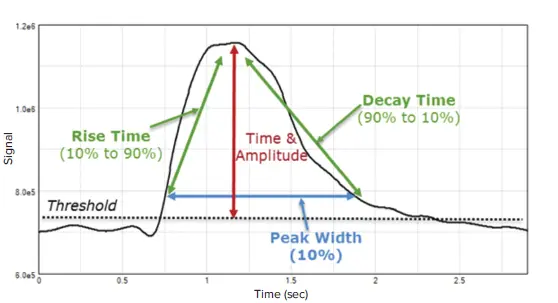
図1. SoftMax ProソフトウェアのPeak Pro解析アルゴリズムで計算されるパラメータの例 ソフトウェアのプロトコールライブラリに含まれるEarlyTox心毒性アッセイプロトコールを使用することで、最大14種類のピーク属性を計算可能です。
このアッセイの有効性を示すために、非常に強力な神経毒性を持つ殺鼠剤**テトラメチレンジスルホテトラミン(tetramine、TETS、以下TMDT)**を使用しました。TMDTの作用は、GABAₐ channelsを介したCl⁻イオンの流入を阻害し、制御不能な脱分極、ニューロンへの過剰なカルシウム流入、興奮毒性を引き起こします。その結果、難治性てんかん重積状態、心機能異常、昏睡、死に至ります。現在、特異的な解毒剤は存在せず、最適な対策を発見するためのエビデンスに基づく体系的アプローチも不足しています。そこで、TMDTや類似化合物に対する潜在的な解毒剤を迅速に特定するため、初代皮質ニューロンを用いた有効なin vitroスクリーニング法を開発しました。
本研究では、ケタミンを含むいくつかの薬剤が、TMDTによる細胞内カルシウム増加を効果的に逆転させ、この化合物の神経毒性作用を防ぐ可能性があることを示しました。これらのin vitroデータは、ケタミンがTMDT誘発性の致死性けいれんおよび死亡率を用量依存的に改善する可能性を示したマウスモデルでの以前の観察結果を裏付けるものです(Shakarjian et al. 2012)。このアッセイは、解毒剤の同定プロセスにおいて動物実験の代替となる信頼性が高く、費用対効果の高いin vitro手法であり、細胞内カルシウム調節に関与する未知の化合物の特性評価にも有用です。
方法
初代皮質ニューロン培養の準備
妊娠18日目のラット1匹から初代皮質ニューロンを分離しました。母体は倫理規定に従って安楽死させ、子宮全体を解剖し、冷PBSを入れたペトリ皿に移しました。胚を子宮から取り出し、無菌条件下で冷PBSを含む別のペトリ皿に移しました。
各胚の頭部を小型ハサミで切除し、新しい冷PBS入りのペトリ皿に移しました。ピンセットで頭部を固定し、別のピンセットで頭蓋骨を慎重に開き、脳組織を損傷しないようにしました。脳を頭蓋骨から引き離し、嗅球の一部を除去しました。小脳と残りの嗅球を各脳から取り除きました。
脳を無菌PBSに移し、解剖顕微鏡下で背側を上にして配置しました。半球を少し引き離して切断し、片方の半球を内側が上になるように回転させ、2本のピンセット(#55)で髄膜を除去しました。1本で半球を固定し、もう1本で海馬周囲を切除しました。最後に脳幹を除去し、大脳皮質を残しました。同様の操作をもう一方の半球にも行いました。
すべての皮質を回収し(オプション:海馬は初代海馬培養や他の用途に使用可能)、PBS中で約1 mmに細切しました。細切片に、DMEM 1 mL(7.5%加熱不活化FBSを含む)とNeurobasal Complete Medium 1 mL(B27サプリメント2%、GlutaMax-I 0.5 mM、ゲンタマイシン10 μg/mLを含む)を加えました。
火で研磨した3種類のガラスパスツールピペット(大・中・小)を用いて、組織を10~12回ずつ緩やかにトリチュレーションしました。組織が完全に分散したら、DMEMを加えて懸濁液の総量を約10 mLにしました。懸濁液を4°Cで300 g、5分間遠心し、上清を除去後、ペレットを新しいNeurobasal Complete Medium 1 mLに再懸濁しました。
細胞を血球計算盤でカウントし、ポリ-D-リジンでコートした滅菌済み96ウェルブラックウォール・クリアボトムプレートに、1ウェルあたり50,000~80,000細胞、総量100 μLで播種しました。細胞を37°C、5% CO₂で1日間インキュベートし、接着を確認しました。1日後、各ウェルに新しいNeurobasal Complete Medium 100 μLを追加しました。細胞はさらに10日以上培養し、5日ごとに培地の半量を交換しました。細胞は毎日観察し、単層形成、神経突起の伸長、ネットワーク形成を確認しました。
カルシウムフラックス測定
培養14日目の初代ニューロンでは、ベースラインのカルシウムオシレーションが同期したピークとして現れます。細胞密度と培養日数は、カルシウムピークの頻度と振幅を決定する主要因です。このベースラインパターンは、カルシウムフラックスに関与する化合物や薬剤(例:カルシウムチャネルアゴニストやアンタゴニスト)を注入すると急速に変化します。FlexStation® 3 マイクロプレートリーダーは、1回のプレートリードで最大3種類の化合物を注入でき、単一実験で幅広い化合物や薬剤の組み合わせを連続的に評価可能です。
細胞への色素負荷のため、各ウェルから100 μLの培地を除去し、残り100 μLを保持しました。カルシウム感受性色素を含むEarlyTox™ 心毒性キットの作業溶液を製品インサートに従って調製し、各ウェルに100 μL添加しました。ニューロンは37°Cで暗所にて1時間以上インキュベートしました。
カルシウムフラックスは、SoftMax® Proソフトウェアのプロトコールライブラリに含まれるPeakPro解析プロトコールを使用し、FlexStation 3プレートリーダーで測定しました。プレートは蛍光測定モードおよびFlexリードタイプで読み取り、オンボード液体ハンドリングシステムにより化合物をウェルに注入しながら、底面から蛍光シグナル(490 nm励起/525 nm蛍光)を同時検出しました。典型的な設定は、300秒間のベースライン測定後、300秒で最初の化合物を添加し、800秒または1100秒で2番目の化合物を添加するというものです。本アッセイの総測定時間は1900秒です。使用した具体的な設定は表1に示します。アッセイや薬剤に応じて注入タイミングは変動します。代表的な動態トレースは図2に示します。
| パラメータ | 設定値 |
|---|---|
| Read mode | 蛍光 |
| Read type | フレックス |
| 波長 | Ex 490 nm/Em 525 nm |
| PMTと光学系 | PMTゲイン ミディアム、フラッシュ/リード:6 |
| タイミング | 総走行時間(分:秒) 31分40秒、インターバル:1.54秒 |
| 化合物トランスファー 化合物トランスファー数:2 |
トランスファー 1: ピペット高さ:70μL、容量:20μL、速度:2μL/sec: 2μL/秒 時間:300秒、最短15秒 トランスファー 2: ピペット高さ:100μL、容量:20μL、速度:2μL/sec: 2μL/秒 時点:800秒(または1100秒)、最短時間~334秒 |
表1. FlexStation 3プレートリーダーの設定
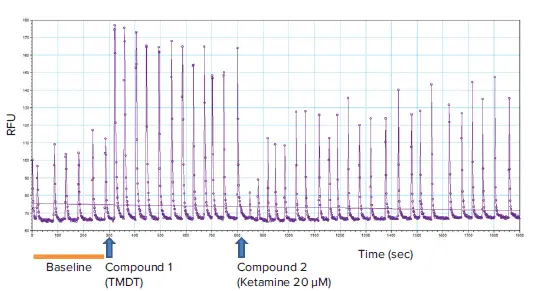
図2. 化合物添加タイムポイントを示す代表的な動態トレース ベースラインカルシウムオシレーション(0~300秒)と化合物添加後のトレース(TMDTは300秒、ケタミンは800秒)が示されています。TMDT(10 μM)は予想通りピーク振幅を著しく増加させ、細胞内カルシウムレベル全体を上昇させました。ピーク頻度には大きな変化は見られませんでした。ケタミン(20 μM)の添加により、TMDT誘発効果はカルシウムオシレーション上で逆転しました。
この実験では、TMDTを5分間(300秒)のベースライン測定後にニューロン細胞へ添加しました。その後、さまざまな化合物を追加し、TMDTの細胞内カルシウムへの影響を恒久的または一時的に逆転できるかを評価しました。複数の化合物に対する代表的な動態トレースは図3に示します。
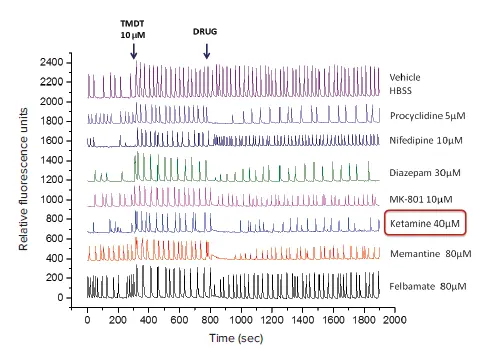
図3. 各種薬剤を細胞に同時注入した際の代表的な動態トレース ベースラインカルシウムオシレーション(0~300秒)、TMDTを300秒で添加後、800秒で各種薬剤を添加したトレースが示されています。TMDT(10 μM)は予想通りピーク振幅を著しく増加させ、細胞内カルシウムレベル全体を上昇させました。薬理学的化合物の添加は、濃度に応じてTMDT誘発効果の逆転効率に差異を示しました。すべてのプロットは**OriginPro 2016 Software(OriginLab Corporation, MA)**で1つのグラフに描画しました。
結果
TMDT(10 μM)をニューロン細胞に添加すると、AUC解析(t検定、p<0.0001)およびピーク振幅(t検定、p<0.0001)で示されるように、細胞内カルシウム総濃度が確実かつ有意に増加しましたが、ピーク頻度には変化がありませんでした(図4Aおよび4B、点線)。各種薬剤は、カルシウムオシレーションに対するTMDT誘発変化の逆転効率に差異を示しました(代表的なトレースは図3)。
ケタミンは3種類の濃度で使用され、主にピーク振幅を低下させることでTMDTの影響を逆転し(ANOVA F(3,42)=13.75, p<0.0001、図4B)、用量依存性を示しました。総カルシウム濃度(AUC)も逆転し(ANOVA F(3,42)=15.66, p<0.0001、図4A)、ピーク頻度への影響は40 μMケタミン添加後に有意差が認められました(ANOVA F(3,42)=4.06, p<0.013、図4C)。ただし、ケタミンの各濃度間で統計的有意差はありませんでした。
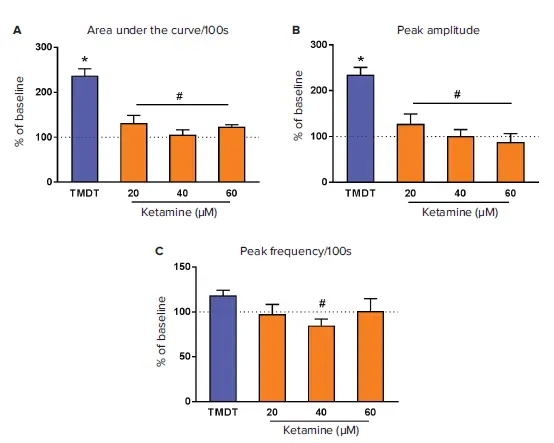
図4. ケタミンによるニューロンカルシウムフラックスの調節 ベースライン測定後、TMDTをFlexStation 3ピペッターでニューロンに添加し、カルシウムフラックスを5分間(300秒)モニタリングしました。その後、ケタミンを所定濃度で添加し、さらに800秒間モニタリングを継続しました。SoftMax ProソフトウェアのPeak Pro解析アルゴリズムを用いた事前設定プロトコールにより、生データの動態トレースから各種パラメータを計算しました。計算項目は、曲線下面積(AUC、A)、ピーク振幅(B)、ピーク頻度(C)で、各パラメータはベースライン(点線)に対する平均値±標準誤差(SEM)(n=2–12)として表しました。*p<0.05はベースラインと比較、#p<0.05はTMDTと比較を示します。グラフ作成と統計解析には**GraphPad Software 6.07(GraphPad Software, Inc., CA)**を使用しました。
結論
細胞内カルシウムは、生理的および病態生理的条件下で多くのニューロン機能を媒介する重要な因子です。本研究では、EarlyTox™ 心毒性キットとFlexStation® 3 マイクロプレートリーダーを用いた初代皮質ニューロンでのカルシウムフラックス測定が、薬理学的化合物の迅速なスクリーニングを可能にし、ニューロン細胞内カルシウムフラックスへの関与を解明する一助となることを示しました。さらに、SoftMax® Proソフトウェアはカルシウム動態のリアルタイム可視化を実現し、実験化合物のカルシウムフラックスへの質的影響に関する即時情報を提供します。これらは特に創薬スクリーニングにおいて重要です。また、ソフトウェアは曲線下面積、ピーク振幅、ピーク頻度など複数のパラメータを自動定量化し、作用機序に関する有益な情報を提供します。
参考文献
Shakarjian MP, Ali MS, Velíšková J, Stanton PK, Heck DE, Velíšek L. 2012. Differential antagonism of tetramethylenedisulfotetramineinduced seizures by agents acting at NMDA and GABA(A) receptors. Neurotoxicology. 48:100-8.
PDF版(英語)