Application Note SpectraMax MiniMaxで
Oris Proアッセイによる細胞移動解析
- 各ウェルの単一画像から細胞移動を正確に測定します
- 広いシグナルウィンドウで、StainFreeまたは蛍光イメージ解析の柔軟性を得られます
- SoftMax Proソフトウェアを使用して、移動した細胞を含む関心領域を自動解析します
PDF版(英語)
はじめに
細胞移動は、細胞がある場所から別の場所へ移動する現象であり、正常および異常な生物学的プロセスの重要な要素です。細胞移動が多様な生物学的プロセスにおいて重要であることから、そのメカニズムを研究するためのシステムが開発されてきました。これにより、細胞移動を促進(創傷治癒)または阻害(腫瘍形成)する治療成分の特定が可能になります。
本研究では、SpectraMax® i3 マルチモードマイクロプレートリーダーのオプションアップグレードであるSpectraMax® MiniMax™ 300 イメージングサイトメーターを用いて、Platypus Technologies社のOris™ Pro Cell Migration Assayによる細胞移動の可視化と解析の実現可能性に焦点を当てています。このアッセイは、非毒性で生体適合性のあるゲルを使用し、各ウェルの中央に細胞フリーの検出ゾーンを形成します。これにより、細胞が検出ゾーンへ移動する際のメカニズムを研究することができます。
材料と方法
細胞培養とアッセイ
HT1080細胞を、Oris Pro Cell Migration Assayに付属するCorning社製の黒色クリアボトムプレートに播種しました(96ウェルプレートでは20,000 cells/well、384ウェルプレートでは8,000 cells/well)。ここではCollagen Iコート版(Platypus Technologies cat. #PROCMACC1)を使用しました。このアッセイは、非毒性の生体適合性ゲルを用いて細胞培養面に細胞フリーゾーンを形成します。
播種後、細胞を加湿チャンバー(37°C、5% CO₂)に約4時間置き、細胞の接着を促しました。その後、新しい培地を添加し、細胞移動を阻害することが知られている細胞透過性マイコトキシンである試験化合物cytochalasin D、または0.1% DMSOのビークルコントロールを加えました。48時間後、プレートをインキュベーターから取り出し、MiniMaxサイトメーターを用いて各ウェルの透過光画像を取得し、後にモレキュラーデバイスのStainFree™ Cell Detection Technologyで解析しました。
細胞はCellTracker™ Green CMFDA Dye(Thermo cat. #C2925)で染色し、MiniMaxサイトメーターの緑蛍光チャンネルを使用して蛍光画像を取得しました。画像取得後、SpectraMax® i3リーダーの蛍光検出モードで蛍光エンドポイント測定(励起472 nm、蛍光526 nm)を行い、細胞移動の検出に使用できるかを確認しました。
各ウェルの細胞移動量は、取得した画像内で溶解した生体適合性ゲルによって形成された検出ゾーンに対応する関心領域を指定して解析しました。SoftMax® Proソフトウェアを使用し、StainFree技術で透過光画像を解析しました。CellTracker Greenで染色した細胞については、SoftMax Proの蛍光強度に基づく細胞検出アルゴリズムを使用しました(図1)。
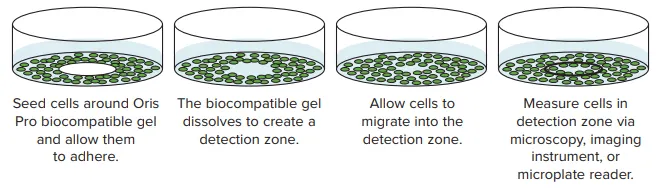
図1. Oris Pro Cell Migration Assayの模式図。 このアッセイは、非毒性の生体適合性ゲルを使用してウェル中央に細胞フリーゾーンを形成します。細胞播種後、ゲルが溶解し、細胞がウェル中央の検出ゾーンに移動します。MiniMaxサイトメーターで取得した画像では、検出ゾーンに対応する関心領域を指定し、細胞移動のレベル(細胞で覆われた面積)を解析します。
MiniMaxサイトメーターとSpectraMax i3プレートリーダーのパラメータ
細胞移動は、MiniMaxサイトメーターで各ウェルの検出ゾーンを表す画像部分を解析することで評価しました。96ウェルまたは384ウェルプレートの各ウェルで、単一サイトまたは4サイトを撮像しました。4サイトを撮像した場合、SoftMax Proソフトウェアが自動的に各ウェルのタイル状コンポジット画像を作成しました。画像解析に加え、SpectraMax i3リーダーの蛍光検出モードも使用し、検出ゾーンへの細胞移動を測定しました(表1)。
| SpectraMax i3 – Endpoint | MiniMax cytometer – Imaging | |
|---|---|---|
| Plate types | 96- and 384-wells | 96- and 384-wells |
| Read mode | Fluorescence | Camera |
| Read type | Endpoint with bottom read | Fluorescence or transmitted light |
| Wavelengths/bandwidths |
Ex: 472 nm/15 nm Em: 526 nm/25 nm |
Ex 456/Em 541 or TL channel |
| Reads per well | 1 read, 6 flashes per read | 1 site per well or 4 sites per well |
表1. 細胞移動アッセイの装置設定。
データ解析
MiniMaxサイトメーターでは、各ウェルの中央から1サイトまたは4サイトをイメージングしました。SoftMax Proソフトウェアを使用し、画像内で溶解した生体適合性ゲルによって形成された細胞フリー検出ゾーンに対応する関心領域を指定しました。検出ゾーンに移動した細胞はソフトウェアによって識別され、結果は移動した細胞が覆った面積の割合として表されました。
SpectraMax i3プレートリーダーでは、ボトムリードのエンドポイント測定タイプを使用して蛍光強度を取得しました。データは4パラメータカーブフィットでグラフ化され、cytochalasin DのIC₅₀値がSoftMax Proソフトウェアによって計算・報告されました。
結果
cytochalasin Dによる細胞移動阻害の濃度依存的効果は、細胞を0.1% DMSOまたはcytochalasin Dの増加濃度に曝露することで測定しました。MiniMaxサイトメーターを使用して、透過光画像およびCellTracker Greenで染色した蛍光画像を取得し、各ウェルの細胞移動レベルを視覚的に確認しました。単一サイトまたは4サイトを撮像し、細胞移動を正確に測定するために最適なイメージングサイト数を決定しました。
96ウェルプレートでは、cytochalasin Dとビークルコントロールのウェル間で、透過光画像および蛍光画像の両方で明確な視覚的差異が確認できました(図2:単一サイト、図3:4サイト)。画像解析の結果、cytochalasin Dは検出ゾーンへの細胞移動レベルに強い濃度依存的効果を示しました(図4)。
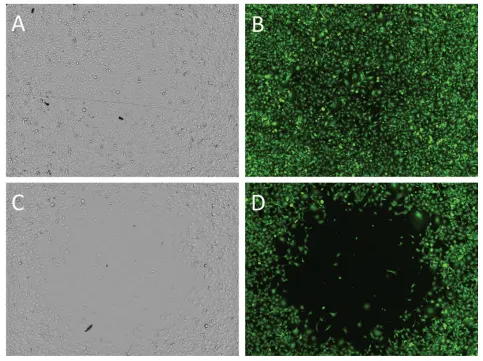
図2. Cytochalasin Dは96ウェルプレートにおける細胞フリー検出ゾーンへの細胞移動レベルに明確な阻害効果を示します。 各ウェルの細胞フリー検出ゾーンは、透過光(AおよびC)と緑蛍光(CellTracker Greenで染色した細胞;BおよびD)の両方で、ウェルごとに単一サイトをイメージングして調査しました。ウェルは0.1% DMSO(AおよびB)または2 μM cytochalasin D(CおよびD)に曝露しました。DMSOコントロールに曝露したウェルでは、多くの細胞が検出ゾーンに移動しました。2 μM cytochalasin Dでは、検出ゾーンに移動した細胞は非常に少数でした。
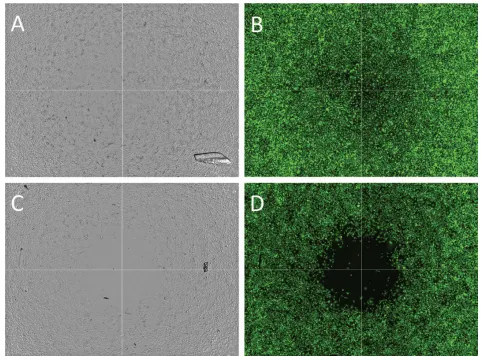
図3. ウェルごとに4サイトをイメージングした細胞移動の画像。 各ウェルの細胞フリー検出ゾーンは、透過光(AおよびC)と緑蛍光チャンネル(CellTracker Greenで染色した細胞;BおよびD)の両方で4画像モンタージュを取得して調査しました。ウェルは0.1% DMSO(AおよびB)または2 μM cytochalasin D(CおよびD)に曝露しました。単一サイトの画像と同様に、DMSOコントロールではcytochalasin処理ウェルよりも多くの細胞が移動していました。
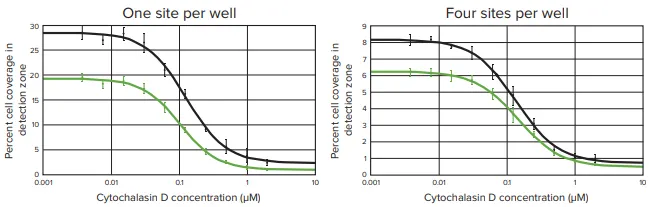
図4. Cytochalasin Dは、96ウェルプレートの透過光画像およびCellTracker Green染色画像の両方で、細胞移動に対して濃度依存的な阻害効果を示します。 ウェルはさまざまな濃度のcytochalasin Dに曝露され、ウェル中央(1またはfour sites/well)の透過光画像(黒プロット)またはCellTracker Green染色画像(緑プロット)を解析し、検出ゾーンへの細胞移動レベルを測定しました。細胞移動レベルは、各ウェル中央の関心領域における細胞で覆われた面積の割合として解析しました。
cytochalasin Dによる細胞移動阻害の用量反応効果は、384ウェルプレートでアッセイされ、Oris Pro Cell Migration Assayのハイスループット環境での有効性を評価しました。96ウェルプレートの画像と同様に、透過光画像および緑蛍光チャンネル画像の両方で、cytochalasin DとDMSOコントロールのウェル間に細胞移動の明確な差異が確認されました(画像は非表示)。単一サイトと4サイトのイメージング間で細胞移動に質的な差異は見られませんでした。画像解析の結果、cytochalasin Dは再び検出ゾーンへの細胞移動レベルに強い濃度依存的効果を示しました(図5)。
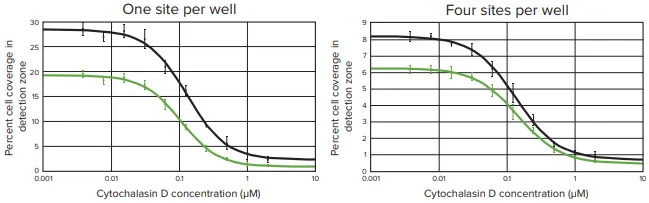
図5. Cytochalasin Dは、384ウェルプレートの透過光画像およびCellTracker Green染色画像の両方で、細胞移動に対して濃度依存的な阻害効果を示します。 ウェルはさまざまな濃度のcytochalasin Dに曝露され、ウェル中央(1またはfour sites/well)の透過光画像(黒プロット)またはCellTracker Green染色画像(緑プロット)を取得し、検出ゾーンへの細胞移動レベルを測定しました。細胞移動レベルは、各ウェル中央の関心領域における細胞で覆われた面積の割合として解析しました。
画像解析に加え、CellTracker Greenで染色した細胞の蛍光強度をSpectraMax i3プレートリーダーの蛍光検出モードで測定しました(図6)。96ウェルおよび384ウェルプレートフォーマットの両方で、cytochalasin D濃度の増加に伴い蛍光強度が大幅に低下し、MiniMaxサイトメーターで取得した画像で観察された細胞移動の減少と一致しました。これらの結果は、SpectraMax i3プレートリーダーがOris Pro Cell Migration Assayプレートを用いた細胞移動の検出に十分な感度を持つことを確認しました。IC₅₀値およびZ'因子はSoftMax Proソフトウェアで計算され、結果は表2にまとめられています。StainFree細胞解析、蛍光画像解析、および蛍光プレートリードで類似した結果が得られました。
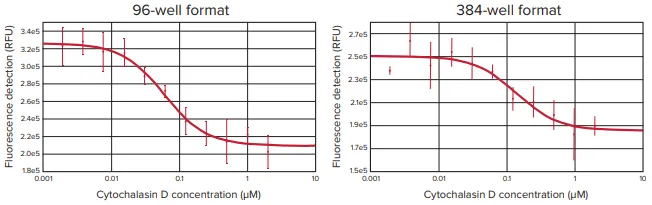
図6. CellTracker Greenで染色した細胞は、SpectraMax i3プレートリーダーで測定した場合、cytochalasin D濃度の増加に伴い蛍光が低下します。 96ウェルプレート(左)または384ウェルプレート(右)の細胞は、cytochalasin Dの濃度増加に曝露され、CellTracker Green蛍光はエンドポイントリードタイプで測定しました。蛍光強度の濃度依存的低下は、cytochalasin Dによる細胞移動阻害と一致します。
概要
MiniMaxサイトメーターの透過光および緑蛍光イメージング機能を使用することで、cytochalasin DがOris Pro Cell Migration Assayプレートにおける細胞移動を阻害することが明確に示されました。96ウェルおよび384ウェルアッセイの両方で同様の阻害効果が確認されました。どちらのフォーマットでも、ウェルごとに単一サイトまたは4サイトを撮像しても阻害効果を測定できました。これらの結果は、Oris Pro Cell Migration Assayを使用することで、ウェルごとの単一画像から細胞移動を正確に測定でき、96ウェルプレート全体やハイスループット384ウェルフォーマットでの迅速なデータ取得が可能であることを示しています。
cytochalasin Dによる細胞移動阻害は、SpectraMax i3プレートリーダーの蛍光検出モードでも測定可能でしたが、標準偏差は画像解析よりも高くなりました。これらの結果は、SpectraMax i3プレートリーダーのオンボード蛍光検出機能を使用して細胞移動を研究するオプションを提供します。
SpectraMax i3 マルチモードマイクロプレートリーダーは、Platypus Technologies社のOris Pro Cell Migration Assayを用いた細胞移動研究に最適です。特許出願中のSpectral Fusion™イルミネーションにより、SpectraMax i3プレートリーダーは細胞移動のような要求の高いアッセイに対応する最適な感度と拡張シグナルレンジを提供します。このプラットフォームはMiniMaxサイトメーターでアップグレード可能であり、StainFreeまたは蛍光イメージ解析の柔軟性を提供し、さらに広いシグナルウィンドウを実現します。
| MiniMaxサイトメーター | SpectraMax i3 | ||||
|---|---|---|---|---|---|
| Transmitted light | Green channel fluorescence |
Endpoint read Ex. 472 nm Em. 522 nm |
|||
| 1 image/well | 4 images/well |
4 images/well |
4 images/well |
||
| 96 well | 0.130 | 0.138 |
0.139 |
0.147 |
0.060 |
| 384 well | 0.129 | 0.138 |
0.106 |
0.109 |
0.142 |
表2. SpectraMax i3プラットフォームで異なる検出方法により得られたIC₅₀(nM)値の概要。 Cytochalasin Dは、透過光画像、緑チャンネル蛍光画像、およびエンドポイント蛍光リードで類似したIC₅₀値を示しました。
SpectraMax i3x マルチモードマイクロプレートリーダーについてさらに詳しく >>
PDF版(英語)