Application Note CHO細胞を用いたクローニング手法の比較:
従来法 vs CloneSelectシングルセルプリンターf.sight
- 細胞分注プロセスのリアルタイムイメージングを提供し、即時の品質管理フィードバックを可能にします
- 2台の独立した装置で取得したシングルセル画像の記録により、モノクロナリティの高い確率を保証します
- 高効率なセルソーティングにより、リミティングダイリューションと比較してクローンの増殖を5倍以上改善します
- フローサイトメトリーと比較して、ソート後の生存率を最大15倍向上させることで、非常に感受性の高い細胞株の単離を可能にします
PDF版(英語)
はじめに
Shan Liu, PhD | シニア細胞株開発サイエンティスト | モレキュラーデバイス
細胞株開発に関する規制がますます厳格化する中、研究者はシングルセルクローニングを実施し、細胞株がシングルセル由来であること(モノクロナリティの証明)を示す必要があります。
モノクロナリティを確立するための一般的な方法の1つは**リミティングダイリューション(LD)です。これは確率に基づくプロセスであり、プレート内のウェルのうち、シングルセルを含む可能性があるのはわずか10~30%に過ぎません。もう1つの従来法であるフローサイトメトリー(FC)**によるセルソーティングは、より高い効率で各ウェルにシングルセルを分注できますが、ソーティング時の高い流体圧がソート後の細胞生存率に無視できない影響を与える可能性があります¹–²。さらに、装置のメンテナンスやトレーニングにかかる高コストは、リソースが限られたユーザーにとって障壁となります。そのため、コスト効率の高い細胞株開発ワークフローと高効率なクローニング手法が求められています。CloneSelect™ シングルセルプリンター f.sight™(以下、f.sight)は、このニーズに応えるために設計されており、シングルセルをウェルにやさしく分注し、細胞分注プロセス全体をイメージングしてタイムスタンプを付与することで、モノクロナリティの画像証拠を提供し、細胞株開発における優れた分注後の細胞増殖を実現します。
本研究では、動物由来成分不使用(ACF)の細胞培養培地とサプリメントを用いて、2種類のCHO細胞株をクローニングする6セットの実験を行い、f.sightと他の2つの一般的なクローニング手法(FCおよびLD)の性能を比較しました。
材料と方法
使用したCHO細胞株は2種類です。細胞株#1はThermo Fisher Scientific(R80007)から購入した親株FreeStyle™ CHO-S細胞株、細胞株#2はモレキュラーデバイス社の独自細胞株であるヒトIgG分泌CHO DG44細胞株です。両細胞株は、すべての実験に先立ち、XP CHO Growth A培地(K8860、モレキュラーデバイス)に4 mM L-グルタミン(25030081、Fisher Scientific)を添加して少なくとも4継代培養しました。
各細胞株のクローニング培地の構成要素とサンプル調製のワークフローは同一です。クローニング培地は、EX-CELL® CHOクローニング培地(C6366、Sigma SAFC)に4 mM L-グルタミンと2.5% ClonaCell™-CHO ACFサプリメント(3820、STEMCELL)を添加して新たに調製しました。クローニング前に、細胞は播種密度0.35×10⁶ viable cells/mLでクローニング培地に48時間適応させ、対数増殖期に到達させました。クローニング当日、1,000万個の細胞を回収し、37°Cで15分間、1 µM CAM(R8343A、モレキュラーデバイス)で染色しました。染色後、細胞はプレーン培地で2回洗浄し、プレーンなクローニング培地に懸濁、30 µMセルストレーナーで濾過し、1×10⁶ viable cells/mLの密度に調整した後、以下の3つのクローニング手法に適用するために3本のチューブに分けました。
f.sight法
プレートは完全なクローニング培地であらかじめ充填(200 µL/well)しました。1×10⁶ viable cells/mLの密度を持つシングルセル懸濁液60 µLを滅菌済みディスポーザブルセルカートリッジにロードしました。カートリッジを f.sightに装着し、細胞サイズ、円形度、蛍光強度などのユーザー定義パラメータに基づき、標準的な96ウェルプレート(Corning 3300)5枚に1ウェルあたり1細胞の密度で分注しました。
FC法
分注準備が整った染色済み細胞を、あらかじめ充填されたプレート(200 µL/well)とともにBD FACS Aria™ Fusionソーターに移しました。蛍光のない、または低い未染色細胞を蛍光セルソーティングの基準として使用しました。細胞はノズル(85 µM、シース圧45 psi)を通過し、蛍光強度に基づいてソートされ、標準的な96ウェルプレート5枚に1ウェルあたり1細胞の密度で分注しました。
LD法
1×10⁶ viable cells/mLの密度を持つ染色済み細胞を1:1000(1×10³ viable cells/mL)に希釈し、播種密度0.33 viable cells/wellを目標としました。1:1000希釈液から165 viable cells(165 µL)を取り、100 mLの完全クローニング培地を含むメディアボトルに加えました。細胞はボトルを軽く回転させて混合し、標準的な96ウェルプレート5枚に200 µLずつ分注しました。
すべての播種済みプレートは、細胞をプレート底面に沈降させるため、イメージング前に200 gで3分間遠心しました。プレートはCloneSelect™ Imager(CSI)システムで透過光のみを用いて、播種から細胞増殖確認までの日0、1、2、7、14にイメージングしました。
シングルセルカウントとコロニーカウントは細胞画像の手動レビューに基づいて評価しました。細胞コンフルエンシーはCSIソフトウェアを用いてウェル単位で自動計算しました(図1)。カウントの判定基準は6セットの実験全体で一貫して適用しました。すべてのシングルセルイベントは、分注後1日目、2日目、または7日目の細胞増殖を確認することでさらに検証しました。シングルセル様粒子や非生存細胞を含むウェルは空ウェルとしてカウントしました。ウェルの端にシングルセルが分注され、モノクロナリティの確認が困難な場合、そのウェルは研究から除外しました。シングルセル分注効率は、日0にシングルセルを含むウェル数を、上記基準で除外されなかった総ウェル数で割って算出しました。アウトグロース効率は、日14に20個以上の細胞が集まったコロニーを含むウェル数を、総ウェル数で割って算出しました。
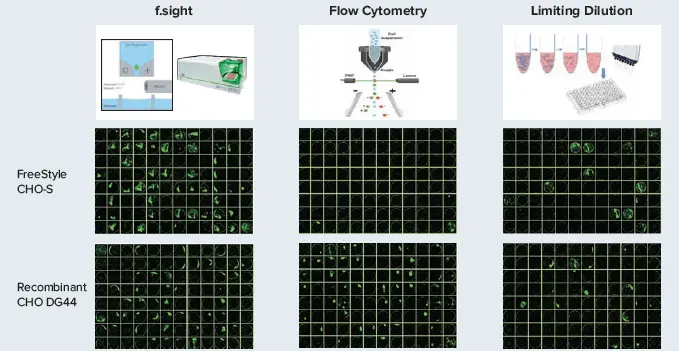
図1 上のプレート画像は、シングルセル分注から14日後の細胞増殖を示しています。緑の疑似カラーは、CSIでブライトフィールドイメージングされたコロニーのセグメンテーションによるものです。
結果
表1に示すように、シングルセル分注効率およびアウトグロース効率は、細胞株や採用したクローニング手法によって大きく異なります。
| 細胞 type | クローン法 | 対象ウェル | シングルセルウェル | 多細胞ウェル | シングルセル由来のコロニーを含む細胞 | シングルセル効率(%) | 成長効率(%) |
|---|---|---|---|---|---|---|---|
| FreeStyleCHO-S | f.sight (SUM) Mean± SD (n=5) |
467 93.4 ± 1.8 |
385 77.0 ± 3.1 |
11 2.2 ± 0.8 |
262 52.4 ±6.0 |
385/467 82.4% ± 3.0% |
262/467 56.1% ± 5.8% |
| FreeStyleCHO-S | FC (SUM) Mean± SD (n=5) |
463 94.6 ± 0.5 |
304 60.8 ± 2.4 |
12 2.4 ± 1.1 |
16 3.2 ± 1.3 |
304/473 64.3% ± 2.8% |
16/473 3.4% ± 1.4% |
| FreeStyleCHO-S | LD (SUM) Mean± SD (n=5) |
467 92.2 ± 2.8 |
61 12.2 ± 2.4 |
17 3.4 ± 1.5 |
45 9.0 ± 2.3 |
61/461 13.2% ± 2.2% |
45/461 9.7% ± 2.3% |
| Recombinant CHO DG44 | f.sight (SUM) Mean± SD (n=5) |
466 93.2 ± 1.3 |
402 80.4 ± 1.8 |
14 2.8 ± 0.8 |
247 49.4 ±7.8 |
402/466 86.3% ± 3.0% |
247/466 53.1% ± 8.8% |
| Recombinant CHO DG44 | FC (SUM) Mean± SD (n=5) |
462 92.4 ± 1.8 |
307 61.4 ± 3.6 |
11 2.2 ± 1.8 |
228 45.6 ± 5.9 |
307/462 66.5% ± 4.1% |
228/462 49.4% ± 6.9% |
| Recombinant CHO DG44 | LD (SUM) Mean± SD (n=5) |
466 93.2 ± 1.9 |
61 12.2 ± 1.3 |
32 6.4 ± 2.7 |
51 10.2 ± 1.3 |
61/466 13.1% ± 1.3% |
51/466 10.9% ± 1.3% |
表1 3種類の異なる手法による2種類のCHO細胞のクローニング概要(f.sight:CloneSelectシングルセルプリンターf.sight、FC:フローサイトメトリー、LD:リミティングダイリューション)。
一般的に、シングルセル分注効率の平均値は、両細胞株においてFCよりもf.sightの方が約10~20%高い結果となりました(FreeStyle CHO-Sではそれぞれ64.3% ±2.8% vs. 82.4% ±3.0%、リコンビナントCHO DG44ではそれぞれ66.5% ±4.1% vs. 86.3% ±3.0%)(図2A)。この効率低下は、FCで観察された分注後の生存率低下によるアーティファクトである可能性は低く、シングルセルカウントの過小評価につながることはありません。なぜなら、CHO DG44細胞はすべての実験で同様の生存率を示したためです。予想どおり、LD法は3種類のクローニング手法の中で最も低いシングルセル効率を示しました(FreeStyle CHO-Sで13.2% ±2.2%、リコンビナントCHO DG44で13.1% ±1.3%)。
アウトグロース効率について、FreeStyle CHO-S細胞ではf.sightがFCより最大16.5倍、LDより5.7倍高い結果となりました(f.sight vs. FC vs. LD:56.1% ±5.8% vs. 3.4% ±1.4% vs. 9.7% ±2.3%)。一方、リコンビナントCHO DG44細胞では、FCによる平均アウトグロース効率はSCP(f.sight)とほぼ同等でした(49.4% ±6.9% vs. 53.1% ±8.8%)。このことは、FCによるクローニング効率が細胞株依存であることを示唆しています(図2B)。また、リコンビナントCHO DG44細胞におけるf.sightのアウトグロース効率は、LDより約4.8倍高い結果となりました(53.1% ±8.8% vs. 10.9% ±1.3%)。
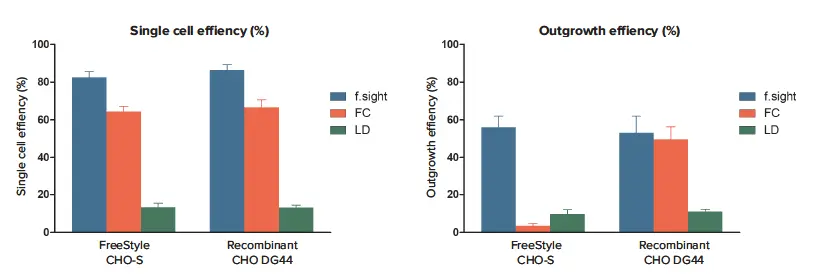
図2 f.sightとフローサイトメトリー(FC)、リミティングダイリューション(LD)の性能比較:シングルセル分注効率とアウトグロース効率 A: f.sightは、テストした各細胞タイプにおいて、シングルセル分注効率でFCおよびLDを上回りました(FreeStyle CHO-Sの場合:f.sight vs. FC vs. LD = 82.4% ±3.0% vs. 64.3% ±2.8% vs. 13.2% ±2.2%、n=5;リコンビナントCHO-DG44の場合:86.3% ±3.0% vs. 66.5% ±4.1% vs. 13.1% ±1.3%、n=5)。 B: f.sightは、テストした3種類のクローニング手法の中で最も高いアウトグロース効率も示しました(FreeStyle CHO-Sの場合:f.sight vs. FC vs. LD = 56.1% ±5.8% vs. 3.4% ±1.4% vs. 9.7% ±2.3%、n=5;リコンビナントCHO-DG44の場合:53.1% ±8.8% vs. 49.4% ±6.9% vs. 10.9% ±1.3%、n=5)。
結論
CloneSelectシングルセルプリンターf.sightは、テストした各細胞タイプにおいて、クローンのアウトグロース効率に関して、リミティングダイリューションおよびフローサイトメトリーによるセルソーティングの両方を上回りました。
LDクローニングでは、両細胞タイプでシングルセルクローンは得られましたが、さらなる特性評価に使用できるクローン細胞は、プレートに播種された細胞の約10%に過ぎません。
FC法では、FreeStyle CHO-S細胞において、播種から増殖までの2週間のインキュベーション期間中にほとんどクローンのアウトグロースが得られませんでしたが、リコンビナントCHO DG44細胞ではf.sightと同等のアウトグロース率が得られました。両細胞株は実験期間を通じて同じ条件で処理されたため、この大きなアウトグロースの差異は、FC分注プロセス中の高い流体圧(45 psi)と、各細胞株の高流体圧に対する感受性の違いに起因する可能性が高いと考えられます *2。
f.sightは、細胞株開発において、従来のクローニング手法を改善し、やさしく効率的なセルソーティング方法を提供します。このアプローチは、蛍光セルソーティング後に細胞増殖が不良になりがちな、高流体圧に対する耐性が低い感受性の高い細胞株のシングルセル分離に特に有用です。
参考文献
- Gross A, Schoendube J, Zimmermann S, Steeb M, Zengerle R, Koltay P. Technologies for Single-Cell Isolation. Int J Mol Sci. 2015;16(8):16897–16919
- Mollet M., Godoy-Silva R., Berdugo C., Chalmers J.J.: Computer simulations of the energy dissipation rate in a fluorescence-activated cell sorter: Implications to cells. Biotechnol. Bioeng. 2008;100:260-272
PDF版(英語)