Application Note SpectraMax i3 マルチモードマイクロプレートリーダーでの
デルフィア細胞増殖アッセイ
- ウェルあたり〜34細胞までの細胞を高感度に検出
- 30年以上の細胞密度の広いダイナミックレンジ
- SoftMax Proソフトウェアで設定済みのプロトコル
PDF版(英語)
はじめに
細胞増殖は、細胞集団に対する化合物の毒性やサイトカインの影響を調べる際に測定すべき重要なパラメータです。細胞増殖にはDNAの合成が必要であるため、細胞増殖を正確に測定する方法の一つは、修飾チミジンヌクレオチドBrdU1 の取り込みをモニターすることです。DELFIA®細胞増殖アッセイは、増殖細胞の新しく合成されたDNA鎖へのBrdUの取り込みに基づく時間分解免疫測定法です。
BrdUはマイクロプレート中で培養された細胞に添加され、そこで増殖細胞のDNAに取り込まれます。取り込まれたBrdUは、ユーロピウム標識モノクローナル抗体を用いて検出されます。細胞を固定し、DNAを変性させます。その後、結合していない抗体を洗浄し、DELFIAインデューサー試薬を加え、ユーロピウムを標識抗体から溶液中に解離させ、蛍光性の高いキレートを形成させます。蛍光は、各ウェルの細胞集団におけるDNA合成量に比例します。時間分解検出により、バックグラウンド蛍光や化合物による干渉が最小化され、他の蛍光ベースの細胞増殖法よりも感度が高くなります。
このアプリケーションノートでは、SpectraMax® i3 マルチモードマイクロプレートリーダーを使用して、HeLa細胞における化学療法薬パクリタキセルとエトポシドの細胞毒性を評価するためにデルフィア細胞増殖アッセイを使用しました。
材料
- DELFIA Cell Proliferation Assay Kit(パーキンエルマー)
- HeLa細胞株(ATCC)
- HeLa用完全培地
- FBS(Gemini Bio-Products)
- ペニシリン-ストレプトマイシン (Thermo Fisher Scientific)
- 1x MEM (Corning)
- 96ウェル、クリアボトム、組織培養処理済みマイクロプレート (Corning)
- SpectraMax i3 マルチモードマイクロプレートリーダー - SpectraMax 時間分解蛍光(TRF)検出カートリッジ(モレキュラーデバイス、型番:#0200-7008)
方法
90%コンフルエントに増殖したHeLa細胞をトリプシン処理し、数を数え、96ウェルクリアボトム組織培養マイクロプレート(黒)に1ウェルあたり10,000細胞ずつ播種しました。細胞を一晩接着させ増殖させた後、パクリタキセルまたはエトポシドの連続希釈液で48時間処理しました。デルフィア細胞増殖アッセイは以下に記述するように行いました。詳細については、キットのテクニカルデータシートをご参照ください *2。
デルフィア細胞増殖アッセイのダイナミック・レンジを決定するため、HeLa細胞をウェル当たり11~75,000細胞の密度で播種しました。細胞播種後直ちに標識溶液を添加し、以下に述べるようにアッセイを行いました。
試薬の調製
- 100μMのBrdU標識溶液は、BrdU標識試薬を滅菌培地で1:100に希釈して調製しました。得られた溶液は遮光しました。- 100 μg/mL の原液を Assay Buffer で 1:200 に希釈し、0.5 μg/mL の抗 BrdU-Eu 作用液を調製しました。- 洗浄濃縮液を蒸留水で 25 倍に希釈し、洗浄液としました。
アッセイ手順
- 細胞を100μM標識試薬の1/10量、例えば200μLの培地で培養した場合は20μLで標識し、37℃のインキュベーターで24時間インキュベートしました。- ウェルから標識試薬を除去し、100μLのFix Solutionを各ウェルに添加しました。プレートを室温で30分間、オービタルシェーカー( \~100-120 rpm)でインキュベートしました。- Fix Solutionをウェルから十分に除去しました。0.5 μg/mL抗BrdU-Euワーキング溶液100μLを各ウェルに添加し、プレートをオービタルシェーカーで室温、60分間インキュベートしました。- 抗BrdU作業溶液を除去し、ウェルを1ウェルあたり300μLの洗浄液で手動洗浄しました。200μLのDELFIA Inducerを各ウェルに添加しました。- プレートを室温で15分間、オービタルシェーカーでインキュベートした後、ユーロピウム蛍光発光を測定しました。
SpectraMax i3リーダーの最適化された設定(表1)を用いてアッセイを検出しました。結果は、SoftMax® Proソフトウェアであらかじめ設定されたプロトコルを用いて解析し、グラフ化しました。
| Parameter | Setting |
|---|---|
|
Optical configuration |
TRF Detection Cartridge |
|
Read mode |
TRF |
|
Read type |
Endpoint |
|
Wavelengths |
Ex 370 nm Em 616 nm |
|
PMT and Optics |
Number of pulses:100 Excitation Time: 0.05 ms Measurement Delay: 0.25 ms Integration Time:0.4 ms Read Height:2.36 mm |
表1. デルフィア細胞増殖アッセイの装置設定。検出カートリッジには励起光源と光学系が含まれています。最適化されたPMTおよび光学系の設定は、キットのテクニカルデータシートに記載されている値とは若干異なり、SpectraMax i3プレートリーダー用に最適化されたものです。
結果
化学療法薬パクリタキセルとエトポシドで処理したHeLa細胞は、文献で報告されたものと同程度のIC50値を示しました(図1) *3,*4。パクリタキセル(タキソール)のIC50値は1.4 nMでしたが、トポイソメラーゼII阻害剤であるエトポシドのIC50値は0.81 μMと、はるかに強力ではなかったです。デルフィア細胞増殖アッセイのダイナミックレンジは約3.5桁(デケード)にわたっていました。無細胞のアッセイブランクを含めることで、ウェルあたり約34細胞という検出下限値を算出することができました(図2)。
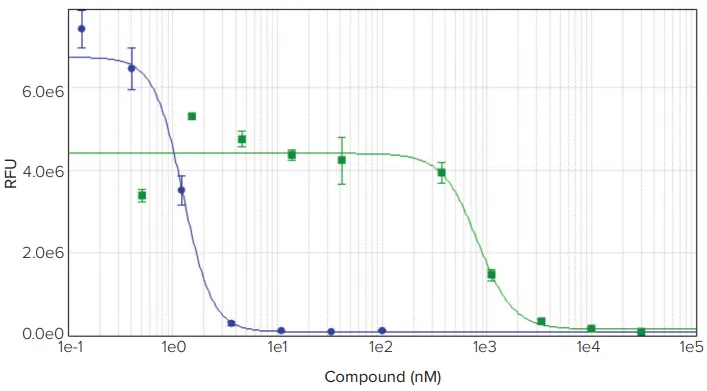
図1. HeLa細胞をパクリタキセル(青丸)またはエトポシド(緑四角)で48時間処理しました。パクリタキセル、IC50 = 1.4 nM;エトポシド、IC50 = 0.81 μM。IC50値はSoftMax Proソフトウェアで計算しました。
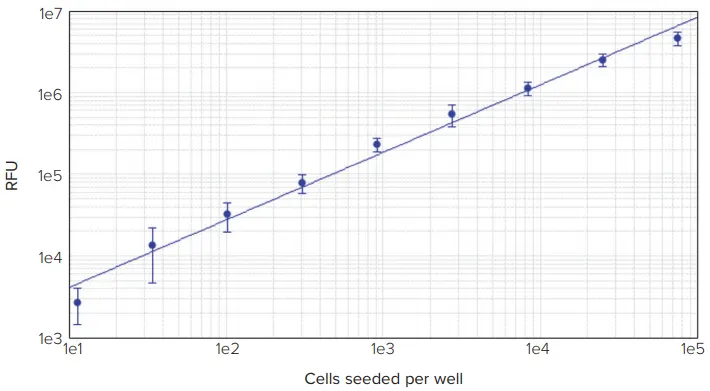
図2. アッセイのダイナミックレンジは、細胞の連続希釈をカウントすることで評価しました。上図に示しますように、線形範囲は1ウェルあたり約75,000細胞から約34細胞までに及びます(R² = 0.99、n = 8)。
結論
上記の結果に示されるように、デルフィア細胞増殖アッセイとSpectraMax i3プレートリーダーを組み合わせると、研究者は細胞増殖を測定するための非常に高感度な検査を行うことができます。このアッセイは、図1に示すように、化合物の毒性を正確に調べることができます。このアッセイのダイナミックレンジは約3.5桁であり、1ウェルあたり約34細胞までの高感度な検出が可能です。そのため、さまざまな細胞密度や実験処理条件下で使用できる非常に汎用性の高いアッセイとなっています。
参考文献
1. Gratzner HG. 1982. Monoclonal antibody to 5-bromo- and 5-iododeoxyuridine: A new reagent for detection of DNA replication. Science Oct 29; 218(4571): 474-5. 2. Technical Data Sheet: DELFIA Research Reagents, Cell Proliferation Kit. 3. Liebmann JE et al. 1993. Cytotoxic studies of paclitaxel (Taxol) in human tumour cell lines. British J. Cancer 68.6: 1104. 4. Lock RB and Stribinskiene L. 1996. Dual Modes of Death Induced by Etoposide in Human Epithelial Tumor Cells Allow Bcl-2 to Inhibit Apoptosis without Affecting Clonogenic Survival. Cancer Research 56: 4006-4012.
SpectraMax i3x マルチモードマイクロプレートリーダーについてさらに詳しく >>
PDF版(英語)