Application Note デュアルルシフェラーゼ発現解析を
FlexStation 3で効率化
- カラム分注と同時検出による高スループットアッセイ
- 1ウェルあたりわずか10細胞で、ファイアフライおよびレニラルシフェラーゼ発現を検出
- アッセイ設定を効率化し、迅速な結果を得るためのプリセットプロトコール
PDF版(英語)
Hoang Ha|アプリケーション・サイエンティスト|モレキュラーデバイス
はじめに
レポーター遺伝子アッセイは、細胞内経路の活性化に関連する遺伝子発現を研究するための重要なツールです。細胞は、レポーター遺伝子と目的配列(通常はプロモーターやその他の転写制御要素)を含むプラスミドでトランスフェクションされます。プロモーターが活性化されると、レポーター遺伝子が発現し、そのレベルを測定できます。
ファイアフライルシフェラーゼは広く使用されているレポーター遺伝子であり、その発光シグナルは蛍光やその他の方法と比較して非常に高い感度を提供します。第二の発光レポーターであるレニラルシフェラーゼは、トランスフェクション効率や細胞数などの変動要因を正規化するため、構成的プロモーターの制御下でよく使用されます。ファイアフライとレニラルシフェラーゼは異なる基質を使用するため、デュアルルシフェラーゼ検出アッセイを用いることで同一ウェル内で両者を測定できます。
SpectraMax® DuoLuc Reporter アッセイキットは、マイクロプレートフォーマットでファイアフライおよびレニラルシフェラーゼの高感度定量を可能にします。ファイアフライ用ワーキング溶液をサンプルウェルに添加するとファイアフライの発光反応が開始され、その後レニラ用ワーキング溶液を添加することでファイアフライ反応を消光し、同時にレニラ反応を開始します。
FlexStation® 3 マルチモードマイクロプレートリーダーは、SpectraMax DuoLucアッセイを96ウェルおよび384ウェルフォーマットで高感度かつ高スループットで実行できます。FlexStation 3プレートリーダーでは、試薬のオンボード分注と発光検出を同時に行い、反応の全過程をリアルタイムでモニタリングします(図1)。
材料
- FlexStation 3 マルチモードマイクロプレートリーダー (モレキュラーデバイス、型番:Flex3)
FlexStation 3 8チャンネルピペッターヘッド(モレキュラーデバイス、型番 #0200-6182)
FlexStation 3 16チャンネルピペッターヘッド(モレキュラーデバイス、型番 #0200-6183)
96ウェル黒色FlexStationピペットチップ(モレキュラーデバイス、型番 #9000-0911)
384ウェル黒色FlexStationピペットチップ(モレキュラーデバイス、型番 #9000-0764) - SpectraMax DuoLuc Reporterアッセイキット(モレキュラーデバイス、カタログ番号 R8361)
- HeLa細胞 (ATCC)
- pGL4.13[luc2/SV40] ホタルルシフェラーゼ発現ベクター (Promega)
- pGL4.75[hRluc/CMV]レニラルシフェラーゼ発現ベクター (Promega)
- ViaFect™ Transfection Reagent (Promega)
- Opti-MEM 還元血清培地 (ThermoFisher Scientific)
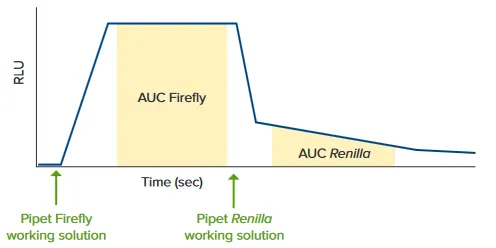
図1 FlexStation 3プレートリーダー上で、試薬添加とともに反応をリアルタイムでモニタリングします ソフトウェアは、反応の各フェーズ(ファイアフライおよびレニラ)における指定部分の曲線下面積(AUC)を計算します。
方法
細胞トランフェクション(Cell Transfection)
HeLa細胞を、組織培養処理済みの6ウェルプレートに1ウェルあたり2×10⁵細胞で播種し、トランスフェクションの24時間前に37°C、5%CO₂でインキュベートしました。pGL4.13[luc2/SV40]ファイアフライルシフェラーゼ発現ベクターはOpti-MEM培地で1 µg/µLに希釈し、pGL4.75[hRluc/CMV]Renillaルシフェラーゼ発現ベクターは100 ng/µLに希釈しました。3本のチューブを以下のように準備し、軽く混合しました:
・Opti-MEM培地400 µL
・pGL4.13[luc2/SV40]ファイアフライルシフェラーゼ発現ベクター2 µL(2 µg)
・pGL4.75[hRluc/CMV]レニラルシフェラーゼ発現ベクター2 µL(2 ng)
各チューブにViaFect試薬6 µLを添加し、軽く混合しました。室温で10分間インキュベートし、トランスフェクション複合体を形成させました。各ウェルに200 µLの複合体を滴下し、軽くスワリングして混合しました。細胞は処理およびアッセイの48時間前までインキュベーターに戻しました。
細胞溶解物の調製(Preparation of Cell Lysates)
トランスフェクション後の細胞をトリプシン処理し、1ウェルあたり10分画に分け、1500 rpmで5分間遠心してペレット化し、PBSで1回洗浄しました。PBSを除去後、細胞ペレットはアッセイまで-80°Cで保存しました。
アッセイ準備時、Passive Lysis Bufferと細胞ペレットを室温に戻し、各ペレットを150 µLのPassive Lysis Bufferで溶解しました。室温で15分間溶解を進めた後、溶解液をPassive Lysis Bufferで1:2の段階希釈を行い、1ウェルあたり4~8700細胞に対応する標準曲線を作成しました。各濃度の細胞溶解液20 µLを96ウェルプレートの3連複に、10 µLを384ウェルプレートの4連複に分注しました。
ルシフェラーゼアッセイのセットアップ(Luciferase Assay Setup)
すべてのキット構成品を室温に解凍しました。
・Firefly Substrate:凍結乾燥基質2.2 mgを含むバイアルに水220 µLを加えて再構成
・Aquaphile™ Coelenterazine:凍結乾燥基質440 µgを含むバイアルに水220 µLを加えて再構成
| Parameter | 96-well | 384-well |
|---|---|---|
| Read mode | Luminescence | |
| Read type | Flex | |
| Wavelengths | All | |
| Integration time | 200 ms | |
| Timing | 2 minutes | 3 minutes 40 seconds |
| Interval time | 3.4 seconds | 5.2 seconds |
| Timing | 2 minutes | 3 minutes 40 seconds |
|
1 st compound transfer |
Add 100 µL of firefly solution Height=50 µL Addition rate=4 Addition time=20 seconds |
Add 25 µL of firefly solution Height=25 µL Addition rate=4 Addition time=20 seconds |
|
2 nd compound transfer |
Add 100 µL of Renilla solution Height=150 µL Addition rate=4 Addition time=60 seconds |
Add 100 µL of Renilla solution Height=75 µL Addition rate=4 Addition time=70 seconds |
| Trituration |
After 1 st compound transfer: Height=50 µL Cycle=2 Volume=50 µL After 2nd compound transfer Height=100 µL |
After 1 st compound transfer: Height=25 µL Cycle=2 Volume=25 µL After 2nd compound transfer Height=25 µL |
| Data reduction |
Firefly: 20 – 67 seconds Renilla : 68 – 120 seconds |
Firefly: 20 – 80 seconds Renilla : 80 – 220 seconds |
表1. FlexStation 3 マイクロプレートリーダーにおける化合物添加およびアッセイパラメーター
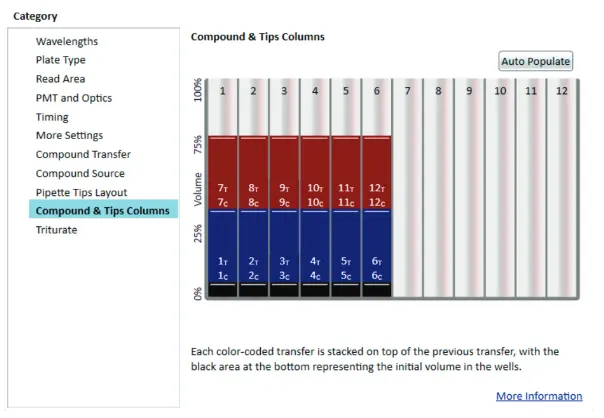
図2 SoftMax Pro 7ソフトウェアのユーザーインターフェース(FlexStation 3マイクロプレートリーダー用)
ソフトウェアの直感的なインターフェースにより、チップおよび化合物カラムの割り当てが簡単に行えます。
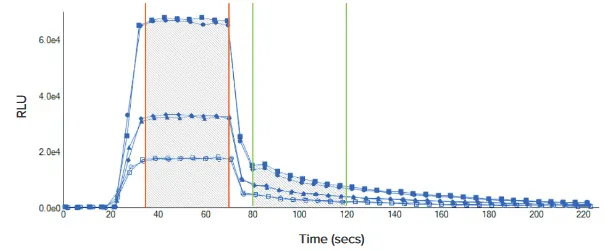
図3 DuoLucキネティックトレース DuoLuc Reporterアッセイの発光シグナルを時間経過で記録し、キネティックトレースを作成しました。上図は384ウェルマイクロプレートフォーマットでアッセイした3種類の細胞濃度を示しています。キネティックトレースのファイアフライ領域(35~70秒)およびレニラ領域(80~120秒)の曲線下面積(AUC)が示されています。試薬の移送は20秒および70秒で行われました。
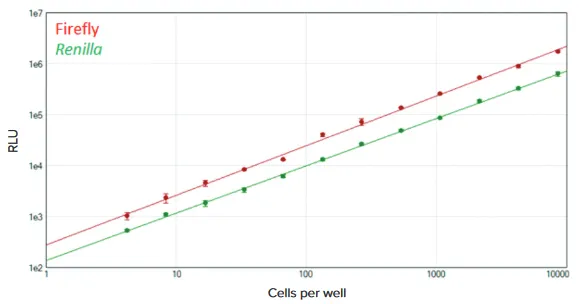
図4 96ウェルフォーマットでのDuoLuc Reporterアッセイ FlexStation 3マイクロプレートリーダーを用いて96ウェルプレートでDuoLuc Reporterアッセイを実施しました。SoftMax Proソフトウェアでログ-ログカーブフィットを用いて、ファイアフライ(赤)およびRenilla(緑)の標準曲線を作成しました(各r² > 0.998)。各希釈について3連複で測定しました。
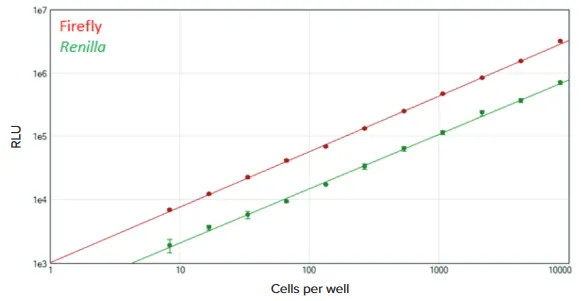
図5 384ウェルフォーマットでのDuoLuc Reporterアッセイ SpectraMax DuoLuc Reporterアッセイを384ウェルプレートで実施しました。SoftMax Proソフトウェアでログ-ログカーブフィットを用いて、ファイアフライ(赤)およびレニラ(緑)の標準曲線を作成しました(各r² > 0.998)。各希釈について4連複で測定しました。
試薬調製
・ファイアフライワーキング溶液:Firefly Assay Bufferでファイアフライ基質を1:50に希釈
・Renillaワーキング溶液:Renilla Assay BufferでAquaphileコエレンテラジンを1:50に希釈
96ウェルプレート1枚分には、各ワーキング溶液11 mLを調製し、それぞれの基質220 µLを添加しました。
SoftMax® Proソフトウェアのプリセットプロトコールを使用し、表1に示すパラメーターで実行しました。ソフトウェアのグラフィカルインターフェースにより、化合物添加の設定が容易に行えます(図2)。FlexStation 3マイクロプレートリーダーは、プレートの1カラム全体に試薬を分注し、Flexリードタイプを用いて定義された時間内に繰り返し測定できます。各サンプルに対してリアルタイムのキネティックトレースが生成され、トレース内でファイアフライとレニラのシグナルを区別し、それぞれの曲線下面積を計算できます(図3)。
結果
SpectraMax DuoLuc ReporterアッセイとFlexStation 3マイクロプレートリーダーを用いて、トランスフェクションしたHeLa細胞中のファイアフライおよびレニラルシフェラーゼを測定しました。96ウェルフォーマットでのアッセイは優れた直線性と高感度を示し、1ウェルあたり約8700細胞から約4細胞まで両方の発光を検出できました(図4)。
384ウェルフォーマットでも同様の性能が確認され、約8細胞まで検出可能でした(図5)。
結論
SpectraMax DuoLuc Reporterアッセイは、FlexStation 3マイクロプレートリーダーの内蔵流体制御機能と発光検出機能を組み合わせることで、哺乳類細胞の遺伝子発現を正確に測定できる高感度なフラッシュ型発光アッセイを提供します。このリーダーは、プレートの1カラム全体に試薬を分注し、選択した総実験時間内で繰り返し測定できるため、デュアルインジェクター方式よりも高いスループットを実現します。さらに、SoftMax Proソフトウェアの直感的なインターフェースとプリセットプロトコールにより、デュアルルシフェラーゼ測定のセットアップ、測定、解析を迅速に行うことができます。
FlexStation 3 マイクロプレートリーダーについてはこちら >>
PDF版(英語)