Application Note Sword ELISAブースターを用いた
ピコグラムレベルでの炎症性サイトカインの検出
- 微量アナライトの高感度測定
- 特許取得済みのSword分子による従来型ELISA化学反応の強化
- 低バックグラウンドノイズと低CV(変動係数)
PDF版(英語)
はじめに
Cathy Olsen(PhD)、Beiyan Zou(PhD)、Young Mee Yoon(PhD)
アプリケーションサイエンティスト|モレキュラーデバイス
従来のELISA(酵素免疫測定法)では、ホースラディッシュペルオキシダーゼ(HRP)基質である3,3’,5,5’-テトラメチルベンジジン(TMB)を使用しますが、炎症性サイトカインのような微量アナライトの検出には限界があります。Sword Diagnostics社は、従来のゴールドスタンダードELISAの検出試薬を直接置き換えることで、最大30倍の感度向上を実現する次世代ELISA検出技術「Sword ELISAブースター」を開発しました。
Sword ELISAブースターは、免疫測定化学に特許取得済みの検出試薬を追加することで機能します。Sword分子は、HRPの存在下で共鳴ラマン活性基質に変換され、蛍光マイクロプレートリーダーで共鳴ラマンシグナルが検出されます。低濃度での酵素/基質反応が優れているため、より多くの共鳴ラマン活性分子が生成され、アッセイ性能が向上します。従来のELISA検出化学と比較して、高感度、低CV(変動係数)、低ノイズを実現します。
本試験では、炎症性サイトカインであるTNF-αおよびIL-1βのELISAをSword ELISAブースターを用いて実施し、モレキュラーデバイスのSpectraMax® iD3、i3x、M5マルチモードマイクロプレートリーダーの蛍光測定モードで検出しました。いずれのプレートリーダーでも、両アナライトを低ピコグラムレベルで測定することができました。
材料
- Sword ELISA Booster for Human IL-1ß (Sword Diagnostics)
- ヒト IL-1ß/IL-1F2 デュオセット ELISA (R&D Systems)
- ヒトTNF-α用Sword ELISAブースター (Sword Diagnostics)
- ヒトTNF-αデュオセットELISA(R&D Systems)
- Immuno Clearスタンダードモジュール(ストリップウェルプレート)、Nunc MaxiSorpプレーティング(Thermo Scientific)
- SpectraMax iD3マルチモードマイクロプレートリーダー
- SpectraMax i3x® マルチモードマイクロプレートリーダー
- SpectraMax M5マルチモードマイクロプレートリーダー
- MultiWash+ マイクロプレートウォッシャー
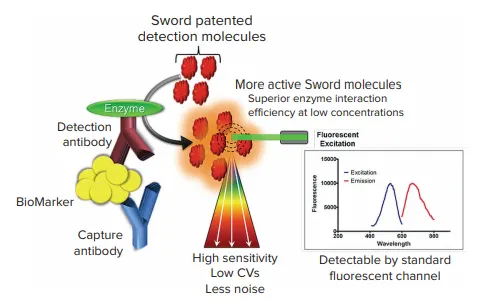
図1:Sword ELISAブースター技術 特許取得済みのSword分子は蛍光リーダーで検出されます。
方法
以下に、両キットの作業用溶液の調製、プレート準備、アッセイ手順を示します。試薬の取り扱いや詳細な手順については、製品添付文書をご参照ください。
Sword ELISAブースター基質溶液の調製
96ウェルプレート1枚分(16 mL)を調製するために、11.2 mLの精製水に以下を添加しました:
- Sword Booster Component A(10倍濃縮):1.6 mL
- Sword Booster Component B(10倍濃縮):1.6 mL
- Sword Booster Component C(10倍濃縮):1.6 mL
1X Sword発色溶液の調製
96ウェルプレート1枚分(16 mL)を調製するために、5X Sword Development Solution(Component D)3.2 mLを精製水12.8 mLに添加しました。
プレート準備
IL-1βおよびTNF-αキャプチャ抗体は、それぞれ0.5 mLのPBSで再構成して抗体濃縮液を調製しました。濃縮ヒトTNF-αキャプチャ抗体はPBSで12 µg/mLに希釈し、ヒトIL-1βキャプチャ抗体はPBSで4 µg/mLに希釈して作業用濃度としました。各アッセイプレートのウェルには、それぞれの希釈抗体を100 µLずつ添加し、プレートを密封して4℃で一晩インキュベートしました。
MultiWash+マイクロプレートウォッシャーを使用して、各ウェルを400 µLの洗浄バッファー(PBS + 0.5% Tween 20)で3回洗浄しました。各洗浄前に15〜30秒間洗浄液をウェル内に保持しました。その後、IL-1βまたはTNF-α用のSword ELISAブロッカーを200 µLずつ添加し、プレートを密封して室温で1時間以上インキュベートしました。吸引と洗浄は上記と同様に行いました。
アッセイ手順
ヒトIL-1β標準品およびヒトTNF-α標準品は、それぞれ0.5 mLの精製水で再構成して濃縮液を調製しました。IL-1βは3倍希釈、TNF-αは4倍希釈で連続希釈を行い、標準曲線を作成しました。IL-1βの濃度範囲は2500〜0.046 pg/mL、TNF-αは1000〜0.244 pg/mLでした。
IL-1βアッセイでは、各ウェルにSword Diluent for IL-1βを50 µL添加し、続いて標準品を50 µL添加しました。TNF-αアッセイでは、Sword Diluent for TNF-αを100 µL添加し、標準品も100 µL添加しました。プレートは密封し、室温で2時間振とうインキュベートしました。その後、プレートは前述の方法で吸引・洗浄しました。
ヒトIL-1βおよびTNF-α検出抗体は、それぞれ1 mLのキャリブレーター希釈液(PBS中10% BSA)または試薬希釈液(PBS + 1% BSA)で再構成しました。各抗体は、R&D Systemsのロット別分析証明書に記載された作業用濃度に希釈しました。希釈抗体を100 µLずつウェルに添加し、プレートを密封して室温で2時間、遮光状態で振とうインキュベートしました。吸引と洗浄は前述の通り繰り返しました。
Sword ELISA HRPコンジュゲートを試薬希釈液で1:10,000に希釈し、各ウェルに100 µL添加しました。プレートは密封し、室温で20分間、遮光状態で振とうインキュベートしました。吸引と洗浄は前述の通り繰り返しました。
Sword Booster溶液を150 µLずつ各ウェルに添加し、プレートを室温で15分間、暗所で静置しました。続いてSword Development溶液を150 µLずつ添加し、プレートを室温で30分間、暗所で静置しました(蓋やシールは使用せず、ウェルの内容物がこぼれないよう注意しました)。
プレートは、表1に示す設定でSpectraMaxプレートリーダーを用いて測定しました。
|
パラメータ |
SpectraMax iD3 |
SpectraMax i3x | SpectraMax M5 |
|---|---|---|---|
| 光学構成 | 該当なし | モノクロメーター | 該当なし |
| Read mode | FL(蛍光) | ||
| タイプを読む | エンドポイント | ||
| 波長 |
530 nm Ex 710 nm Em |
530 nm Ex 710 nm Em |
530 nm Ex 710 nm Em (630 nm カットオフ) |
| プレーティングタイプ |
96ウェルスタンダード(最適化済み) |
||
| PMT and optics |
PMTゲイン: 自動 積分時間 500ミリ秒 上面からの読み取り 読み取り高さ:1 mm |
PMTゲイン: 高い 読み取りごとのフラッシュ数 6または100 上からの読み取り 読み取り高さ:5.34 mm |
PMTゲイン: 自動 読み取りごとのフラッシュ数: 100 上から読む |
表1:Swordアッセイ検出におけるSpectraMaxプレートリーダーの設定 SpectraMax iD3およびSpectraMax M5プレートリーダーは、モノクロメーター方式の光学系を採用しているため、設定時に光学構成を選択する必要はありません。
結果
標準曲線は、標準品の平均RFU値とその濃度をプロットすることで作成されました。SoftMax Proソフトウェアでは、Sword Diagnosticsの推奨に従い、データを4パラメータロジスティック曲線にフィッティングしました。
アッセイ性能は、推奨される検出限界(LOD)および定量下限(LLOQ)のパラメータを用いて評価されました。Sword DiagnosticsによるLODの定義は、ゼロ標準品の平均値とその標準偏差の2倍を超えるシグナルを示す最も低い標準品濃度です。LLOQは、LOD以上の濃度で、逆算された精度が80〜120%、CVが25%以下の最も低い標準品濃度と定義されています。
試験に使用された3種類のSpectraMaxプレートリーダーは、各製品添付文書に記載されたLLOQの基準をすべて満たしました。IL-1βキットではLLOQは0.42 pg/mLが一般的であり、TNF-αキットでは0.98 pg/mLとされています。SpectraMaxプレートリーダーでは、IL-1βで0.41 pg/mL、TNF-αで0.98 pg/mLのLLOQが得られました(表2)。
IL-1βおよびTNF-αの標準曲線はSoftMax Proソフトウェアでプロットされました(図2および図3)。各アッセイにおけるEC₅₀値は、3種類のプレートリーダー間で同等でした(表2)。
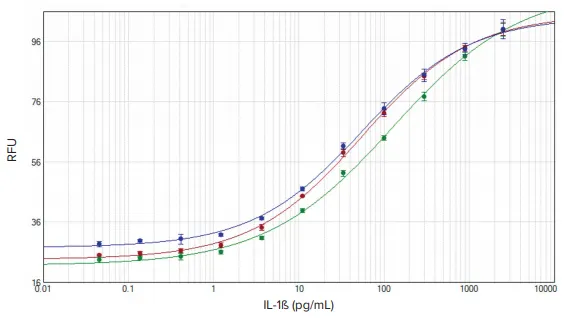
図2:IL-1β標準曲線 SoftMax Proソフトウェアによる4パラメータフィッティングを用いて、SpectraMax iD3(赤)、SpectraMax i3x(緑)、SpectraMax M5(青)プレートリーダーで得られたデータをプロット。
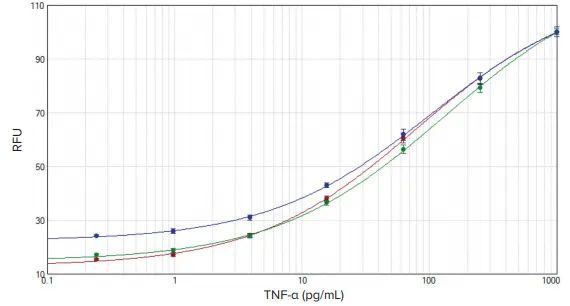
図3:TNF-α標準曲線 SoftMax Proソフトウェアによる4パラメータフィッティングを用いて、SpectraMax iD3(赤)、SpectraMax i3x(緑)、SpectraMax M5(青)プレートリーダーで得られたデータをプロット。
| プレートリーダー |
IL-1ß LLOQ (pg/mL) |
TNF-α LLOQ (pg/mL) |
IL-1ß EC50 |
TNF-α EC50 |
|---|---|---|---|---|
| SpectraMax iD3 | 0.41 | 0.98 | 54.6 | 78.9 |
| SpectraMax i3x | 0.41 | 0.98 | 127.0 | 131.7 |
| SpectraMax M5 | 0.41 |
0.98 |
54.3 | 101.5 |
表2:SpectraMaxプレートリーダーで得られた定量下限(LLOQ)および標準曲線のEC₅₀値の比較
結論
今回試験した3種類のSpectraMaxプレートリーダーは、Sword ELISAブースターに求められる感度基準をすべて満たしました。この高感度アッセイにより、IL-1βは0.41 pg/mLまで定量可能であり、従来のTMB基質を用いたR&D SystemsのDuoSet(IL-1β)で報告されている感度3.9 pg/mLと比較して大幅に向上しています。TNF-αについても、0.91 pg/mLまで定量可能であり、R&D Systems DuoSet(TNF-α)の15.6 pg/mLと比較して約17倍の感度向上が確認されました。この9〜17倍の感度向上により、炎症性サイトカインの低濃度検出が可能となり、これらのメディエーターが関与する疾患の理解をさらに深めることができます。
モレキュラーデバイス プレートリーダーでSword ELISAブースター検出に対応している機種:
- SpectraMax® Paradigm® マルチモードマイクロプレートリーダー
- SpectraMax® i3x マルチモードマイクロプレートリーダー
- SpectraMax® iD3/iD5 マルチモードマイクロプレートリーダー
- SpectraMax® M3/M4/M5/M5e マルチモードマイクロプレートリーダー
- FilterMax™ F5 マルチモードマイクロプレートリーダー
謝辞
本アッセイのセットアップおよび解析において、プレートリーダーのバリデーションを実施し、支援いただいたSword Diagnostics社のMegan Dobbs氏に感謝いたします。
PDF版(英語)