Application Note FLIPR Tetraを用いた光遺伝学的
Cav1.3チャネルアッセイ開発
- 光照射による特異的かつ非侵襲的なアッセイ法
- 柔軟で可逆的なアッセイプロトコル
- 電気生理学とカリウム刺激にマッチしたデータ品質
PDF版(英語)
はじめに
Cav1.3はL型電位依存性カルシウムチャネルであり、創薬における重要な治療標的です。多くの薬剤がCav1.3チャネルに対して状態依存的な作用を示すことが報告されています *1。つまり、これらの薬剤の効力は膜電位(Vm)およびそれに伴うチャネル状態(開口、閉鎖、不活性化)の変化に応じて変動します。この特性は、病理的に過剰活性化したCav1.3チャネルに対する選択性を高めるため、異なる状態でチャネル阻害薬を評価するハイスループットアッセイの開発が求められています。
現在、このチャネルのスクリーニングには、膜電位を制御する電気生理学的手法や、カリウム刺激による膜電位変化を利用した蛍光法が用いられています。しかし、両者には大きな制約があります。電気生理学はVmを直接制御できますが侵襲的であり、ハイスループット化には不向きです。一方、蛍光アッセイは生理学的関連性が低く、可逆性がありません。
これらの制約を克服するため、本研究では光遺伝学的手法を用いてChR2(チャネルロドプシン-2) *2 を介しVmを制御する新しいソリューションを報告します。ChR2は光ゲート型非選択性カチオンチャネルであり、主にNa⁺イオンに透過性を持ちます。青色光(470 nm)による活性化でNa⁺流入が起こり、膜電位が持続的に脱分極します。これによりCav1.3チャネルはまず開口状態となり、その後時間経過とともに不活性化状態に移行します。光照射終了後、膜電位は再分極し、Cav1.3チャネルは静止状態に戻ります。
本研究では、FLIPR Tetra®システムを用いて、状態依存的カルシウムチャネル阻害薬のスクリーニングにおける光遺伝学ツールの新しい有用性を実証します。
材料
- HEK-293細胞株は、ChR2D156A(クラミドモナス・レインハルディ由来)、ヒトCav1.3 α1 + α2δ、βサブユニット、およびヒトKir2.3を共発現するようにAxxam S.p.A.(イタリア・ミラノ)で開発されました。Kir2.3の発現により、Vmは初期状態で過分極し、細胞外高濃度カリウム(Kir2.3に作用)またはChR2への青色光刺激(オールトランスレチナール補因子存在下)に応答して脱分極します。いずれの場合も、脱分極したVmはCav1.3を開口させ、細胞内へのカルシウム流入を可能にします。
- 使用機器・試薬:FLIPR Tetra System(0310-5147)、FLIPR® Calcium 6 Assay Kit(R8190)、FLIPR® Membrane Potential Assay Kit(R8042)(すべてモレキュラーデバイス製)。
方法
光遺伝学の強力な応用例は、光感受性アクチュエータを用いたVm制御です。本研究では、C. reinhardtii由来の光感受性タンパク質ChR2を用いて、状態依存的Cav1.3阻害薬のハイスループットアッセイを構築しました。具体的には、ChR2D156A変異体をFLIPR TetraシステムのLED(470 nm)で活性化し、Na⁺透過性と約6.9分の開口状態持続時間³により強力かつ持続的な膜脱分極を誘導しました。その結果、Cav1.3チャネルは開口し、Ca²⁺イオンが細胞内に流入します(図1)。時間経過とともにチャネルは非伝導性の不活性化状態に移行します(図2)。細胞内カルシウムの動態変化はFLIPR Calcium 6 Assay Kitを用いてFLIPR Tetra装置でモニタリングしました。
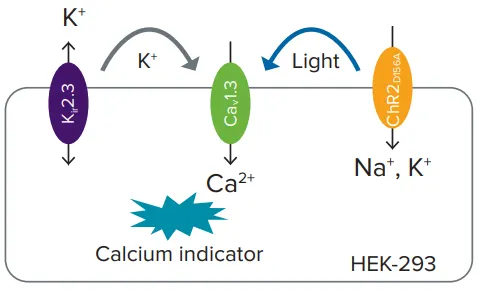
図1. Kir2.3、Cav1.3、ChR2をトランスフェクトしたHEK-293細胞。膜電位(Vm)の脱分極によりCav1.3を介したカルシウムイオン流入が誘導される。この脱分極は高濃度K⁺の添加、またはChR2への光刺激によって実現可能。
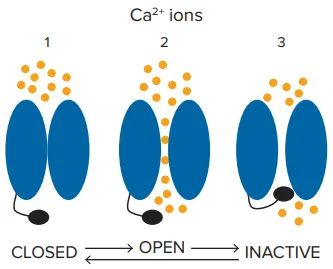
図2. Cav1.3カルシウムチャネルは膜電位に応じて異なる状態を循環する。膜電位が過分極している場合、チャネルは「閉鎖」静止状態にあります。膜電位が脱分極するとチャネルは開口し、カルシウムイオンが細胞内に流入し、その後すぐに「不活性化」状態に移行します。膜電位が再分極すると、Cav1.3カルシウムチャネルは不活性化状態から回復し、閉鎖状態に戻り、再び脱分極刺激に応答できる状態になります。
ChR2による膜電位制御
膜電位をChR2で制御できることを検証するため、FLIPR Membrane Potential染料(励起波長530ナノメートル/蛍光波長565ナノメートル)を用いて膜電位変化に伴う蛍光信号の変化を測定しました。ChR2、Kir2.3、Cav1.3を発現するヒト胎児腎由来HEK-293細胞を、オールトランスレチナール補因子存在下で標準プロトコールに従って染料で処理しました。FLIPR Tetraシステムを用いて、青色発光ダイオードからの光パルスでChR2チャネルを刺激し、膜電位の脱分極を誘導しました。並行して、膜電位染料を励起し、蛍光発光の変化を時間経過で測定しました。膜電位の脱分極は蛍光信号の増加として反映されました。青色光刺激の最初の期間が終了すると、ChR2チャネルは閉鎖状態に移行し、膜電位が再分極して蛍光信号は時間とともに減少しました。
ChR2によるCav1.3カルシウムチャネル制御
ChR2、Kir2.3、Cav1.3を発現するヒト胎児腎由来HEK-293細胞を、オールトランスレチナール補因子存在下でFLIPR Calcium 6染料で処理しました。FLIPR Tetraシステムを用いて、青色光パルスでChR2を刺激し、その後の蛍光変化を測定して、Cav1.3カルシウムチャネルを介したカルシウムイオンの細胞内流入を評価しました。後続の実験では、二重パルスプロトコールを採用し、最初の光パルス後に異なる時間間隔で二度目の光パルスを適用し、Cav1.3カルシウムチャネルの不活性化からの回復を解析しました。
カリウムチャレンジによるCav1.3カルシウムチャネルの制御
比較のため、同じ細胞株を用いて、カリウムチャレンジによるCav1.3カルシウムチャネル活性の標準的な解析方法を実施しました。高濃度カリウムを細胞外に添加すると、膜電位が脱分極し、Cav1.3カルシウムチャネルが開口してカルシウムイオンが細胞内に流入します(図1)。時間経過とともに、Cav1.3カルシウムチャネルは非伝導性の不活性化状態に移行します。FLIPR Calcium 6染料を用いて細胞内カルシウムの増加を測定しました。この方法では、高濃度カリウムの添加が必要であり、生理学的条件とは異なるため、多くの「オフターゲット」効果を引き起こす可能性があります。さらに、この方法は不可逆的であり、カリウムイオンをウェルから除去することはできません。
薬理学的評価
光遺伝学の薬理アッセイへの有用性を検証するため、状態依存的阻害薬イスラジピンを用いてCav1.3カルシウムチャネルを阻害し、閉鎖状態および不活性化状態での半数阻害濃度(IC₅₀)を解析しました。光遺伝学、高濃度カリウム添加(Kir2.3に基づく)、およびパッチクランプの3つの方法を比較し、両状態でのイスラジピンのIC₅₀値を評価しました。
結果
ChR2による膜電位の制御
光で活性化されたチャネルロドプシン2(ChR2)による膜電位制御は、ChR2をトランスフェクトしたヒト胎児腎由来HEK-293細胞をFLIPR Membrane Potential染料で処理することで検証しました。FLIPR Tetraシステムの青色発光ダイオードからの光パルスにより膜電位の脱分極が誘導され、FLIPR Membrane Potential染料の信号は3倍に増加しました(図3A)。膜電位信号を時間経過で記録したところ、初回の青色光刺激から約30分後に蛍光信号は背景レベルに戻り、膜電位が再分極したことが示されました。このデータは、青色光がChR2を開口させると膜電位がまず脱分極し、その後ChR2チャネルが閉鎖するにつれて膜電位が再分極することを示唆しています(図3B)。この変化は、ChR2の開口状態の時間定数である約6.9分に一致します。
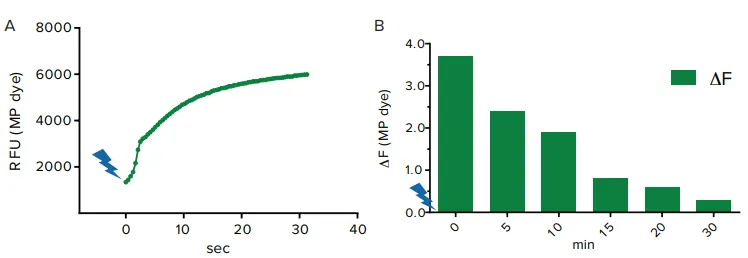
図3. (A) 光刺激による脱分極 青色光照射に伴うFLIPR Membrane Potential染料の蛍光変化として測定された膜電位の脱分極。(B) 時間経過実験。最大蛍光信号の変化を時間軸で表示 ChR2およびCav1.3を発現するHEK-293細胞をFLIPR Membrane Potential染料で処理。青色光パルスによるChR2刺激で膜電位が脱分極し、蛍光信号が初期に増加(T=0)。その後、信号が低下し膜電位の再分極を示します。
ChR2によるCav1.3カルシウムチャネル応答
トランスフェクトしたヒト胎児腎由来HEK-293細胞をFLIPR Calcium 6染料で処理し、青色光パルスを照射すると、蛍光信号が増加しカルシウムイオンの細胞内流入が確認されました(図4A)。後続の実験では、二重パルスプロトコールを用いてCav1.3カルシウムチャネルの不活性化からの回復時間依存性を解析しました。最初の光パルスから10分後に二度目の光パルスを照射した場合、カルシウム信号は最大値の50%でした。45分後に照射した場合、ほぼ100%の信号が記録されました。この結果は、最初の光刺激から10分後には半数のチャネルが不活性化状態にあることを示唆します(図4B)。
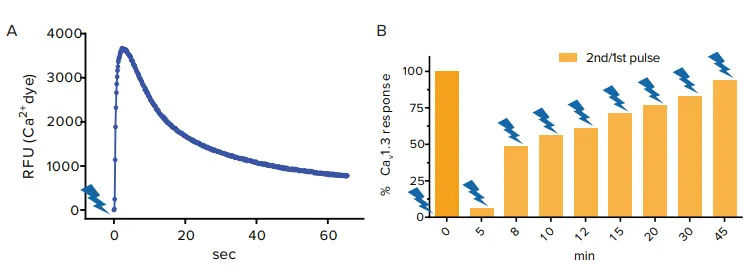
図4. (A) 青色光刺激後のChR2によるCav1.3応答 FLIPR Tetraシステムで記録されたFLIPR Calcium 6染料の蛍光信号増加は、Cav1.3を介したカルシウム流入を示します。(B) Cav1.3の不活性化からの回復 二重パルスプロトコールを適用し、最初の光パルスをt=0で照射後、異なる時間間隔で二度目の光パルスを照射しカルシウムフラックスを測定。10分後の信号は最大値の50%であり、チャネルが半数不活性化状態にあることを示します。
カリウム・チャレンジ
Cav1.3カルシウムチャネルの状態をカリウムで制御するため、トランスフェクトしたヒト胎児腎由来HEK-293細胞株をFLIPR Calcium 6染料のローディングバッファ中で、4ミリモルから75ミリモルまでのカリウム濃度で37℃で1時間インキュベートし、異なる膜電位を誘導しました。その後、FLIPR Tetraシステムでカルシウム信号を検出する際に、75ミリモルの高濃度カリウムを添加しました。代表的なカルシウム信号応答を図5Aに示します。カリウム濃度とFLIPR Calcium 6染料の信号をプロットしたカリウム依存性不活性化曲線では、最大カルシウム信号の50%を誘導するカリウム濃度は22ミリモルであることが示されました(図5B)。この条件では、半数のチャネルが不活性化状態にあることが示唆されます。
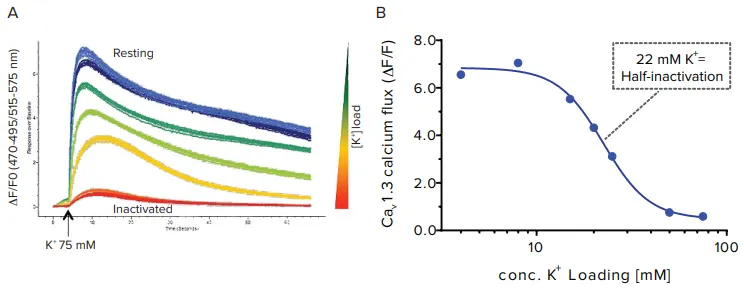
図5 (A) FLIPR Calcium 6蛍光色素をロードした細胞を、異なる[K⁺]条件で処理し、異なる初期膜電位を誘導しました カルシウムシグナル検出中にFLIPR Tetraシステム上で75 mMのK⁺を添加しました。(B) K⁺不活性化曲線 細胞を22 mM K⁺を含む色素でインキュベートすることで、チャネルの50%が不活性化状態になります。
薬理学(Pharmacology)
パーキンソン病の進行を遅らせる可能性がある降圧薬**イシラジピン(isradipine)**は、Cav1.3に対する状態依存的作用が知られているため、本研究で選択されました。ChR2を用いたオプトジェネティックプロトコールにより、Cav1.3を発現するHEK-293細胞をFLIPR Calcium 6蛍光色素とともに37°Cで1時間インキュベートし、異なる濃度のイシラジピンを添加しました。FLIPR Tetraシステムで青色光パルスを照射し、閉状態でのカルシウム流入に伴う蛍光シグナルの増加を測定しました。10分後、再度青色光パルスを照射し、不活性化状態での蛍光変化を記録しました。カルシウムシグナルは初回の半分程度に減少しました。結果は図6aのグラフに% Cav1.3応答として示されています。高K⁺プロトコールに基づくイシラジピンのIC₅₀曲線は図6bに示されています。先行するカリウム実験に基づき、FLIPR Calcium 6蛍光色素のロードバッファに4 mMまたは22 mMのK⁺を添加し、それぞれ閉状態と不活性化状態を誘導しました。カルシウムシグナル検出中には75 mMのK⁺を添加しました。図6cには、パッチクランププロトコールを用いた閉状態および不活性化状態でのCav1.3に対するイシラジピン阻害のIC₅₀曲線が示されています。
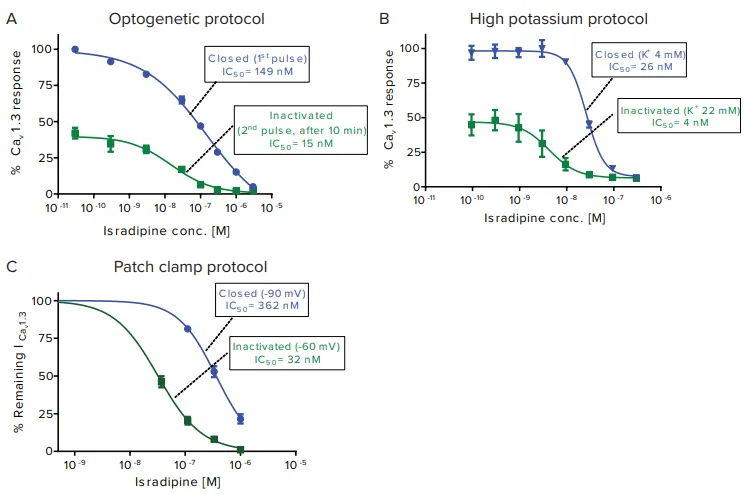
図6 イシラジピンの状態依存性が薬理学に与える影響 (A) オプトジェネティックプロトコール。閉状態(最初の青色光刺激)でのイシラジピンIC₅₀ = 149 nM。不活性化状態(10分後に再度青色光刺激)でのIC₅₀ = 15 nM。(B) 高カリウムプロトコール。検出中に75 mM K⁺を添加。Cav1.3閉状態(4 mM K⁺ロード)でのIC₅₀ = 26 nM。不活性化状態(22 mM K⁺ロード)でのIC₅₀ = 4 nM。(C) パッチクランププロトコール。Cav1.3閉状態(-90 mV保持電位)でのIC₅₀ = 362 nM、不活性化状態(-60 mV保持電位)でのIC₅₀ = 32 nM。
まとめ
閉状態と不活性化状態におけるイシラジピンのIC₅₀値を、従来のパッチクランプ結果を含めて比較したものを表1に示します。不活性化状態では閉状態に比べてIC₅₀値が約10倍低下する傾向が、すべての方法で一貫して確認されました。これは、イオンチャネルに対する化合物の作用が閉状態と不活性化状態で異なる臨床的意味を持つ可能性があるため重要です。オプトジェネティックプロトコールでは、得られたIC₅₀値が「ゴールドスタンダード」である電気生理学的手法の値に近く、比率ブロック値も類似しており、高い生物学的関連性が示唆されます。さらに、電気生理学的アッセイとは異なり、オプトジェネティックアッセイでは実験終了時に細胞が完全な状態で保持されます。また、光駆動型オプトジェネティックプロトコールは可逆的であり、柔軟なアッセイ設計において非常に望ましい特徴です。
| イスラジピンIC50 | オプトジェネティクス | 高K+値 | パッチクランプ | Literature4 |
|---|---|---|---|---|
|
閉鎖状態 |
149 nM |
26 nM |
362 nM | 300 nM (-90 mV) |
|
非アクティブ状態 |
15 nM |
4 nM |
32 nM | 30 nM (-50 mV) |
|
RATIO ブロック 閉鎖/非作動 |
9.9 |
6.5 |
11.3 | 10 |
表1 閉状態および不活性化状態におけるイシラジピンIC₅₀結果のまとめ オプトジェネティックプロトコールの結果は、電気生理学および文献値に最も近い値を示しています。
謝辞
実験および図表はAxxam S.p.A.(イタリア、ミラノ)より提供されました。
参考文献
- Koschak、A.ら、J. Biol. Chem. 2001, 276:22100-22106
- Prigge, M., Rossler, A., Heggeman, P., Channels. 2010, 5月/6月, 4:3, 241-247
- Berndt, A., Yizhar, O., Gunaydin, L., Hegemann, P., Deisseroth, K., Nat Neurosci. 2009, Feb;12(2):229-234.
- Catterall WA, Perez-Reyes E, Snutch TP, Striessnig J. Pharmacol Rev. 2005 Dec;57(4):411-25.
PDF版(英語)