Application Note ハイスループット細胞移動アッセイ
PDF版(英語)
はじめに

細胞移動の生物学は、細胞骨格の変化を引き起こす複雑なタンパク質シグナル伝達機構を含み、重要な生物学的機能に直結します。細胞移動を測定するアッセイは、関与するメカニズムをより詳細に理解するために不可欠であり、創薬や治療法開発において重要な役割を果たします。 化学誘引物質を用いずに細胞移動を測定する一般的な方法のひとつが、スクラッチまたは「傷つけた」細胞単層を用いるウンドヒーリングアッセイです。しかし、このアッセイをハイスループットで実施するには多くの課題があり、その大きな問題のひとつが傷領域の均一性の欠如です。GenentechのLin研究室は、PC-3細胞株における細胞移動が特定の薬剤やshRNA遺伝子ノックダウン処理によって阻害されることを示しました。 ここでは、ImageXpress Velos System-DL™(Blueshift Biotechnologies Inc.)レーザースキャニングプラットフォームと、Oris™ Cell Migration Assayキット(Platypus Technologies)を組み合わせた使用例をご紹介します。このキットは、シリコン製ストッパーを用いて各ウェル中央への細胞付着を防ぎ、ウェル周囲に細胞単層を形成する96ウェルプレート形式です。ストッパーを除去した後、以前ブロックされていた領域への細胞移動を、蛍光検出用のライブセル蛍光色素calcein-AM(Invitrogen)で細胞を標識して測定します。ImageXpress Velos Systemはウェル全体をスキャンできるため、ウェル中央の均一な直径2mmの未播種領域における細胞移動を迅速に測定するのに最適です。結果として、shRNAや薬剤の効果検出に必要な感度を備えた、シンプルで堅牢なハイスループット細胞移動アッセイを可能にする統合的な画像取得・解析プロセスが実証されました。
アッセイ手順
細胞移動アッセイ
Oris™ Cell Migration Assayキット(Platypus Technologies)を用いた細胞移動アッセイは、GenentechのKui Lin研究室と共同で、PC-3細胞モデルシステムを使用して実施しました。簡単に説明すると、細胞を1ウェルあたり15,000細胞で播種し、単層を形成させました。各ウェルからストッパーを除去し、非付着細胞を除去するためPBSで1回洗浄しました。培地および薬剤を添加し、細胞を24時間インキュベートしました。PBSで調製したcalcein-AM溶液(最終濃度0.5 µM)を添加し、ImageXpress Velos Systemで蛍光イメージングを行いました。
細胞移動の蛍光イメージング
このデモで使用したImageXpress Velos System-DLレーザースキャニングプラットフォームは、20mWの488nmレーザーを搭載しています。488nmレーザーは、calceinで標識された細胞の検出に使用され、Ch1(510–540nmバンドパスフィルター)で取得しました。画像取得は5×5 µmのサンプリングで行い、96ウェルプレート全体をスキャンしました。
結果と考察
細胞移動のイメージングと結果
Oris™ Cell Migration Assayは、医療グレードシリコン製ストッパーを使用してウェルの周囲に細胞播種を制限する96ウェル黒壁プレート形式です。ストッパーを除去すると、ウェル中央に直径2mmの未播種領域が現れ、そこに細胞が移動します(図1参照)。図2にはOris™ Cell Migration Assayの手順を示すイラストがあります(Platypus Technologies提供)。

Control 2(C05)、shRNA2 - DOX(C09)、shRNA2 + DOX(C10)図1. shRNA処理と移動なしコントロールの細胞移動アッセイ画像。2mmのストッパーは細胞層にきれいな境界を残しますが、ストッパー除去後の未播種領域にはわずかなアーティファクトが見られます。DOXなしのshRNA2処理(C09)では、未播種領域への細胞移動とより強い細胞増殖が確認されました。対照的に、DOXありのshRNA2処理(C10)では細胞移動と増殖の両方が阻害されました。黄色の円は直径2.5mmのROI(関心領域)を示します。各画像の白文字は、直径2.1mmのROI内で分類されたすべてのオブジェクトの面積カバレッジ率(Cell Area/ROI Area × 100)を示しています。
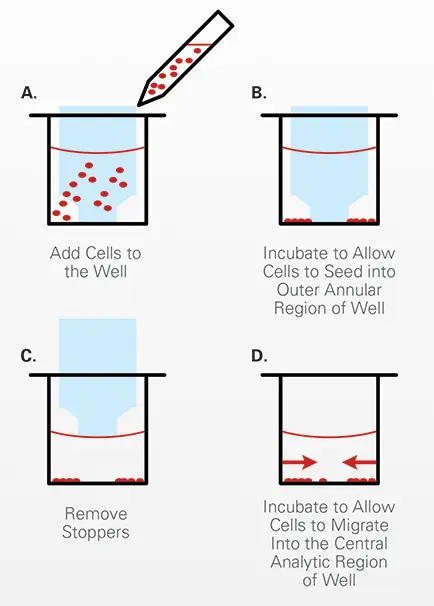
図2. Oris™ Cell Migration Assay手順のイラスト。
Oris™ Cell Migration Assayでは、細胞を24時間処理し、ライブセル蛍光色素calcein-AMで染色しました。ImageXpress Velos Systemレーザースキャニングプラットフォームを用いて各ウェル全体をイメージングし、calcein-AM標識細胞の緑蛍光をCh1(510–540nmバンドパスフィルター)で取得しました。96ウェルプレート全体のスキャンと解析は、本アッセイ条件で5分以内に完了します。
図1にはcalcein標識細胞のウェル全体画像を示します。移動なしコントロール(Control 2)は、calcein標識直前にストッパーを除去したサンプルで、未播種領域にはわずかな細胞が観察されます(図1のC05参照)。すべての画像は、直径2.1mmのROIと細胞より小さいオブジェクトを除去する面積フィルターを用いた統合画像解析プログラムで処理しました。各画像の白文字は、ROI内で分類されたすべてのオブジェクトの面積カバレッジ率を示します。
図1には、shRNA処理が細胞移動に与える影響も示されています。shRNA処理ウェルとコントロールウェルの間に差が認められました。Oris™ Cell Migration Assayを用いて、DOX存在下でPC-3細胞の移動を阻害するshRNA2の能力が確認されました(図1 C10)。移動阻害(C10)は、ストッパーを染色直前に除去したコントロールウェル(C05)の画像と類似しています。対照的に、DOX非誘導のshRNA2処理(C09)ではPC-3細胞が移動しました。これらの予備結果は、ImageXpress Velos System-DLがOrisフォーマットの新しい96ウェル細胞移動アッセイからデータ解析用画像を取得できることを示しており、shRNAスクリーニングシステムのさらなる最適化が必要です。最適化には、未播種領域の細胞背景除去、均一な初期細胞密度の確保、最適な細胞移動のためのインキュベーション時間調整が含まれます。
結論
ImageXpress Velos Systemは、Oris™ Cell Migration Assayに対して迅速かつシンプルな画像取得・解析プロセスを提供します。
- 96ウェルプレート全体の画像取得を5分以内で実現
- 総細胞面積とカバレッジ率を算出する統合画像解析
- プレートリーダーと比較して、ウェル全体イメージングによる高いデータ量とアッセイ感度
- プレートセットアップとサンプル操作は簡単で容易
- 現在96ウェルフォーマットで利用可能
このプラットフォームの独自の光学系とスキャニングエンジンにより、ライフサイエンス研究者のニーズに応えるシンプルな「プラグアンドプレイ」アプリケーションが可能になります。
PDF版(英語)