Application Note FLECS技術を用いた
シングルセル収縮力の
ハイスループットスクリーニング
- 384ウェルプレートに蛍光標識したマイクロパターンを用いて、大規模な薬剤ライブラリーをスクリーニングし、細胞収縮力への影響を調べます
- 各集団内の各シングルセルの収縮力を長時間の実験にわたって追跡
- ハイスループット・ウェルイメージングによる画像取得の迅速化
PDF版(英語)
はじめに
Ivan Pushkarsky|共同設立者兼社長|フォルサイト・バイオテクノロジーズ
Robert Damoiseaux|Forcyte Biotechnologies共同設立者、CNSI分子スクリーニング共有リソースディレクター
Yao Wang|科学者|Forcyte Biotechnologies
Jayne Hesley|シニアアプリケーションサイエンティスト|モレキュラーデバイス
哺乳類細胞が機械的な力(押す、引っ張る、絞る)を発生する能力は、細胞が個々に、あるいは組織として、重要な生理機能を果たすために利用される固有の能力。細胞力発生の背後にあるメカニズムをよりよく理解し、新たな創薬標的や候補を同定し、力発生に影響を及ぼすと考えられる既存の候補を検証するためには、細胞力を機能的に評価する定量的スクリーニングアプローチを採用しなければいけません。重要なことは、機能的な細胞出力がこれらの障害を引き起こすため、カルシウムフラックスのような非特異的な分子サロゲートではなく、力発生そのものを測定することが、薬剤開発の成功を最大化するために重要であるということです。
本研究では、FLECS(Fluorescent Elastomeric Contractible Surfaces:蛍光エラストマー収縮性表面)と呼ばれる自動化シングルセル機能的収縮アッセイを開発し、細胞の緊張性収縮力と、試験化合物が細胞によって加えられる力を調節する能力の両方を評価。致死的喘息患者6名と非喘息患者6名から得られた初代ヒト気道平滑筋(HASM)細胞を、収縮緊張、アゴニストであるブラジキニンに対する反応性、そして最終的に気管支拡張薬であるホルモテロールに対する反応性の観点から比較。全12細胞株のシングルセル収縮能の評価は、1枚のFLECS 384ウェルプレートを用いて行われ、ImageXpress® Micro 4 ハイコンテントイメージングシステムを用いてイメージングされた。ImageXpress Micro 4システムによる一貫したワイドフィールドイメージングにより、10万個を超える収縮シングルセルを、長時間の実験にわたって4分間隔でタイムラプス追跡することが可能になりました。

図1. 細胞結合蛍光マイクロパターンを封じ込めたFLECS 384ウェルプレートのシングルウェル (A)384ウェルプレートのシングルウェル全体をImageXpress Micro 4システムを用いて4倍の倍率で取得することができます。(B)エラストマーベースに埋め込まれた蛍光マイクロパターン(緑)は、シングルセル(赤でアクチン染色、青で核染色)によって接着され、圧迫され、その結果、発生した力の大きさに対応する、空のマイクロパターンに対する規則的で定量可能な寸法変化が生じます。
材料
- FLECSアッセイキット
◦384ウェルFLECSプレート (Forcyte Biotechnologies)
◦Hoechst 33342核染色 (ThermoFisher)
- 初代ヒト気道平滑筋細胞(健常人ドナー6個、喘息ドナー6個)-ラトガース大学Rutgers Institute for Translational Medicine and Science, Panettieri Labより提供。
- 化学物質
◦ブラジキニン酢酸塩(ミリポアシグマ)
◦ホルモテロール(ミリポアシグマ)
- ImageXpress Micro 4 ハイコンテントイメージングシステムとMetaXpressソフトウェア(モレキュラーデバイス)
12系統の患者由来HASM細胞で機能的収縮力を評価
蛍光標識した細胞外マトリックス(ECM)マイクロパターンをソフトベースフィルムに共有結合で埋め込んだアレイを封じ込めたFLECS 384ウェルプレートに、評価する細胞を播種。この研究では、12人の患者(うち6人は致死的喘息患者、6人は非喘息患者)から得られた12系統の初代HASM細胞を評価しました。
初代HASM細胞は、蛍光標識したマイクロパターンを用いて384ウェルプレートにプレーティング。細胞を無血清培地中、37℃で24時間培養しました。細胞をこれらのパターンに接着させ、様々な処理を行えるようにしました。その後、細胞をHoechst 33342で37℃、15分間染色し、マイクロパターンに結合したシングルセルを同定。細胞の収縮は、下地の弾性フィルムに機械的な力を発生させ、パターン周辺部でよくキャリブレーションされた変位を生じました。細胞に結合したマイクロパターンのベースライン画像を、ImageXpress Micro 4システムの4倍対物レンズを用いて取得(核はDAPI、蛍光標識したマイクロパターンはFITC)。次に、細胞をアゴニスト(10μMブラジキニン)で処理し、マイクロパターンを4分ごとに12分間イメージングしました(FITCチャンネルのみ)。次に、細胞を気管支拡張剤(50μMホルモテロール)またはビヒクルコントロールで処理し、マイクロパターンを4分ごとに16分間イメージングしました(FITCチャンネルのみ)。その後、プレートを37℃で10分間インキュベートしてから最終画像を取得。基礎緊張、ブラジキニンに対する収縮反応性、気管支拡張剤ホルモテロールに対する感受性、およびこれらの反応のカイネティックスを、図2に示す手順に従って測定しました。
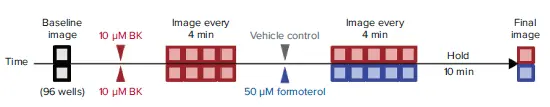
図2. FLECS384ウェルプレートへの12細胞株のプレーティング後の実験手順の説明図
マイクロパターンに結合したシングルセルを同定し、変位を計算
MetaXpress®ソフトウェアから画像をエクスポートし、Forcyteアルゴリズムを用いて収縮力データを処理しました(図3)。マイクロパターンに結合したシングルセルはHoechst染色に基づいて同定。複数の細胞に結合したパターンは除外しました。シングルセルが結合した各パターンについて、中心から各末端までの平均距離がデータポイントを構成します。
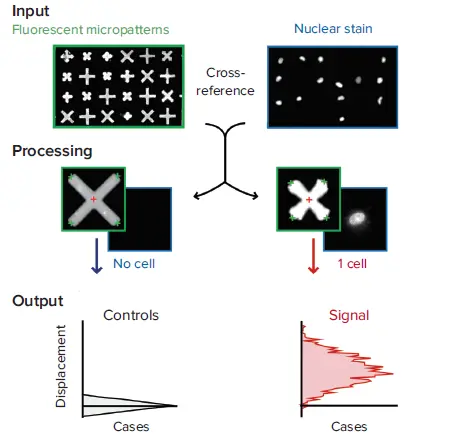
図3. 収縮力データを処理するForcyteアルゴリズム このアルゴリズムは、(i)画像セット1のすべてのマイクロパターンを同定・測定し、(ii)画像セット2の各マイクロパターンの位置を相互参照し、(iii)核(すなわち細胞)が0個、1個、2個以上存在するかどうかを判定しました。1個の核(すなわち1個の細胞)を含むマイクロパターンの中心から末端までの平均変位を、0個の核を含むすべての非変位パターン(すなわち非占有パターン)の対応する測定値の中央値と比較し、その差を水平ヒストグラムとしてプロットしました。
疾患細胞と正常細胞の収縮力プロファイルは有意に異なっていた。
31,000個のアゴニスト応答性細胞(12個の細胞株から)の収縮力を経時的に追跡し、ベースラインに対して16分後に収縮力の増加を示す細胞をさらなる解析のために選択しました(平均72%の細胞)。選択されたすべての細胞について、収縮分布の変化を追跡したところ(図4A)、BK処理後にはロバスト性の上方シフトを示し、ビヒクル添加後には減衰しなかったが、ホルモテロール処理後には停止または逆転することがわかりました。
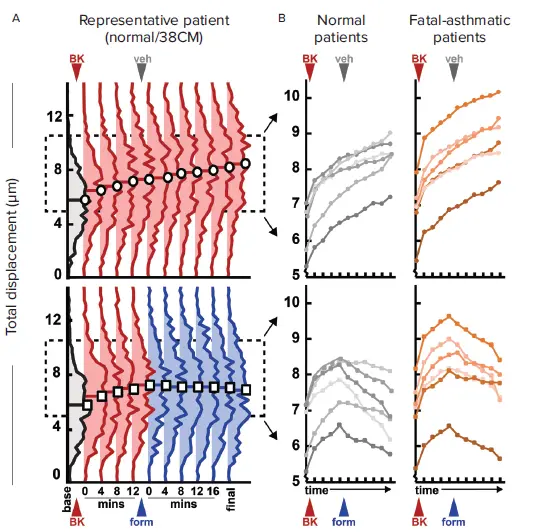
図4. マイクロパターン画像から収集した収縮力データ (A) 収縮促進アゴニストであるブラジキニン、およびその後の気管支拡張薬ホルモテロールまたはビヒクルコントロール(患者1人)による治療後、時間とともに変化する単細胞収縮力測定値の集団レベルヒストグラム。(B) 12人の患者すべてについて、集団全体のヒストグラムから得られた中央値。
各細胞集団の収縮力中央値を薬物治療期間中追跡したところ(図4B)、年齢、人種、性別をマッチさせた6組の患者のうち5組で、致死的喘息の有無にかかわらず、喘息患者の細胞がより大きな緊張、より大きなBK誘発収縮、またはその両方を示すことが観察されました。このうち4例では、その差は統計的に有意でした(図5)。
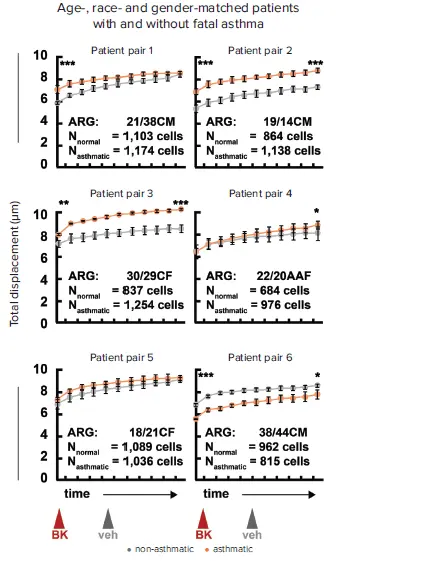
図5. 年齢、性別、人種が一致したドナー細胞の一対比較
結論
FLECSウェルプレート製品およびImageXpress Micro 4システムは、疾患プロセスに関与することが知られている細胞収縮能への影響について、大規模な薬剤ライブラリーを機能的にスクリーニングする手段を提供します。FLECSウェルプレートアッセイでは、標準マイクロプレート底面のエラストマーフィルム上に、正確な形状の接着および蛍光マイクロパターンが多数配列されており、これらのマイクロパターンに接着し、力発生により寸法変化を起こす初代細胞または細胞株について、機能的な力発生を迅速に評価することができます。ImageXpress Micro 4システムは、細胞収縮力の微細な違いを観察するのに十分な空間解像度で、ウェル全体(384ウェル全領域を1枚の画像で)を迅速に(384ウェル全プレートあたり10分未満で)取得することができました。迅速な全ウェルイメージングにより、FLECS技術は、ハイスループットなスクリーニングアプリケーションや、細胞力発生を研究する高分解能・多次元実験に使用できるようになりました。本研究は、以前に発表された大規模研究の一部です *1。
参考文献
- Pushkarsky, I. et al. Elastomeric sensor surfaces for high-throughput single-cell force cytometry. Nature Biomedical Engineering 2, 124-137 (2018).
PDF版(英語)