Application Note 汚染牛IgGアッセイ
PDF版(英語)
はじめに
160,000ダルトンのタンパク質であるウシIgGは、ウシ血清の構成成分の一つです。ウシIgGを含む子牛胎児血清は、組換え医薬品の製造のための哺乳動物細胞培養培地に一般的に使用されています。組換え医薬品の精製過程で、ウシIgGが生成物と共精製される可能性があり、臨床使用において生物学的危険性を示す可能性があります。したがって、哺乳動物細胞に由来する最終製品中の汚染ウシIgGをアッセイすることが必要な場合があります。ウシIgGのアッセイは、プロセス全体を通して製品の精製をモニターするためにも使用できます。
材料
本アプリケーションノートでは、市販の抗ウシ IgG 抗体を用いたウシ IgG アッセイに関する予備的な性能情報を提供します。本書はガイドとして作成されたものであり、本アッセイのバリデーションや最適な性能パラメータを示すものではありません。
- Molecular Devices CorporationのThreshold® System(カタログ番号0200-0500)、1311 Orleans Drive, Sunnyvale, CA 94089、tel: 408-747-1700 または 800-635-5577。
- Molecular Devices Corporationの免疫リガンドアッセイ標識キット(カタログ番号R9002)
- Molecular Devices Corporation製免疫リガンドアッセイ検出キット(カタログ番号R9003)
注:ILA キットに含まれる Assay Buffer Concentrate は、コンタミヒトトランスフェリンアッセイでは一切使用しません。 - *BSA フリーアッセイバッファー。*ILA キットに含まれるアッセイバッファー濃縮液にはウシ血清アルブミン(BSA)が含まれています。アッセイバッファーの調製に使用されるBSAは高品位ですが、アッセイに影響を与えるコンタミトランスフェリンが含まれている可能性があります。ヒトトランスフェリンアッセイにはBSAを含まないアッセイバッファーが使用されます。BSAを含まないアッセイバッファーの処方は以下の通りです。
|
|
|
|---|---|---|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- 表 1: BSA フリーアッセイバッファーの調合。
- BSA フリーアッセイバッファーの 10 倍溶液を脱イオン水で 1:10 に希釈したものを 500 mL 調製し、0.22 µm のフィルターでろ過します。10X ストックは 4℃で保存します。結晶が生じた場合は、室温に温め、結晶を溶解してから 1X 溶液を調製します。バッファーへのコンタミネーションを防ぐため、滅菌済みピペットチップと脱イオン水で十分に洗浄したガラス器具のみを使用します。
- Bovine IgG, whole moleculeはChemicon International Inc.から購入しました(カタログ番号PP03)。ウシIgGの他の供給源も試験しました(Jackson ImmunoResearch, Calbiochem Corp.) ChemiconのウシIgGが最も良好な反応を示しました。IgG標準物質中のIgGサブクラスの比率は供給元によって異なる可能性があり、試験した異なる抗原間で観察された異なる反応を説明する可能性があります。
- ヤギ抗ウシIgG親和性精製ポリクローナル抗体(重鎖および軽鎖)はJackson ImmunoResearch Labs Inc. 他の抗体も試験しました(Jackson ImmunoResearch社のウサギ抗ウシIgG、Chemicon International社のニワトリ抗ウシIgG)。Jackson ImmunoResearchのヤギ抗体が最も良好な反応を示しました。
- オバルブミンはSigma Chemical社から購入しました(カタログ番号A-5503)。
- ストレプトアビジンはScripps Laboratories(カタログ番号S1214)から購入しました(Tel: 619-546-5800)。脱イオン水中の25mg/mLのストレプトアビジンのストック溶液を調製しました。保存温度は4℃でした。
- Sephadex® G-25カラムはPharmacia Biotech社から購入しました(PD-10、カタログ番号17-0851-01)。
- サンプルは、Molecular Devices Corporationの顧客のご厚意によりご提供いただきました。
方法
抗体の標識
ヤギ抗ウシ IgG 抗体は、Threshold System Operator's Manual の ILA セクションおよび ILA アプリケーションノート Optimizing the labeling of proteins に記載されている方法で標識しました。
ヤギ抗ウシ IgG 抗体はリン酸緩衝液中で供給され、防腐剤は含まれていません。従って、抗体は標識前に透析されていません。DNP-ビオチン-NHSまたはフルオレセイン-NHSハプテンを250 µgの抗体とともに、遮光して室温で2時間インキュベートしました。モルカップリング比(MCR)は、標識反応に使用したタンパク質(抗体)1モルあたりのビオチンまたはフルオレセインハプテンのモル数として定義されます。使用したMCRは、フルオレセインが10:1、ビオチンが20:1でした。
25mLのPBS(10mMリン酸、150mM NaCl、pH 7.0)で平衡化したPharmacia PD-10カラムに反応液を通すことにより、未反応のハプテンを抗体から分離しました。タンパク質濃度、タンパク質回収率、モル取り込み比(MIR)は、Threshold System Operator's ManualのILAセクションに記載されているように計算しました。MIRは、タンパク質1モルあたり共有結合したハプテンの平均モル数として定義されます。表 2 に、4 つの独立した標識反応で得られたモル取り込み比を示します。抗体のストック濃度は2~3 mg/mLでした。
標識#MIRビオチン/AbMIRフルオレセイン/Ab
| 標識# | MIR Biotin/Ab | MIR Fluorescein/Ab |
|---|---|---|
| 1 | 3.7 | 3.2 |
| 2 | 4.1 | 3.1 |
| 3 | 4.6 | 5.8 |
| 4 | 4.6 | 5.2 |
表2:4種類の標識で得られたモル導入率
すべての標識は、250 µgの抗体、10:1のフルオレセインと20:1のビオチンのモルカップリング比、2時間のインキュベーション時間で行いました。
標識後、抗体をBSAフリーのAssay Bufferで20 µg/mLに希釈し、キャリアータンパク質として1 mg/mLのオバルブミンを加えました。150μLのアリコートをSarstedt滅菌チューブに入れて-20℃で保存しました。
試験あたりの抗体の最適濃度の決定(ローディング試験)
4種類のビオチン化および蛍光標識抗ウシIgG抗体濃度(20、40、60および80 ng/test)を3種類のウシIgG濃度(0、200および2000 pg/mL)で試験し、バックグラウンド率と傾きを評価しました。傾きとは、抗原濃度の変化に対するシグナルの変化を測定したものです。サンドイッチ形式と連続インキュベーションプロトコルを使用しました(Threshold System Operator's Manual の ILA セクションを参照)。
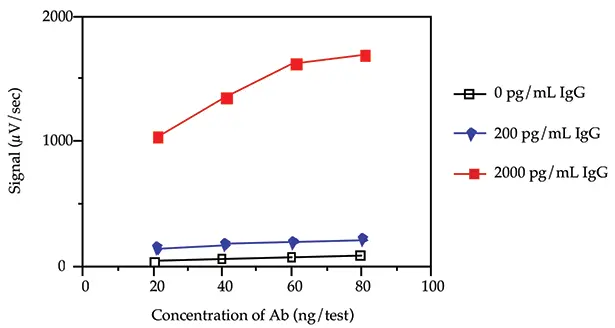
図 1. 負荷試験。
図 1 は、40 ng/test (400 ng/mL)のビオチン化抗体および 40 ng/test (400 ng/mL)の蛍光化抗体濃度により、バックグラウンドシグナルが低く(0 pg/mL ウシ IgG の場合)、ウシ IgG が存在する場合(200 pg/mL および 2000 pg/mL ウシ IgG の場合)でも十分な率が得られることを示しています。本アプリケーションノートでは、残りの実験に 40 ng/test の抗体濃度を使用しました。
アッセイプロトコル
**ステップ 1 **ポリプロピレンチューブに牛 IgG 標準曲線を調製します。ウシ IgG 標準品(ケミコン・インターナショナルのストックウシ IgG 約 20 mg/mL) を BSA フリーアッセイバッファーで連続希釈します。標準品は 5000~50 pg/mL のウシ IgG です。推奨標準品濃度は、5000、2000、1000、500、200、100、50 および 0 pg/ mL のウシ IgG です。
注意 注意:通常のピペットチップ(滅菌済みチップではなく)を使用した場合、バックグラウンドが高くなる例がいくつか観察されています。注意:通常のピペットチップ(滅菌済みチップではなく)を使用した場合、バックグラウンドが高くなることが数回観察されま したが、このコンタミネーションが再現されることはなく、通常のピペットチップに起因すると断定することはできません。
**ステップ 2 **必要であれば、ポリプロピレンチューブにBSAを含まないアッセイバッファーで検体を希釈します。
**ステップ 3 **ビオチン化抗体と蛍光標識抗体をそれぞれ40 ng/test(400ng/mL)の濃度でBSAフリーのAssay Bufferに溶解し、ポリプロピレンチューブに調製します。
**ステップ 4 **ウシ IgG 標準品および検体を 100μL ずつポリプロピレンチューブに分注します。
**ステップ 5 ステップ 3 で調製した抗体 100μL を、エッペンドルフのリピーターピペッターと Combitip® を用いてチューブに分注します。
**ステップ 6 **チューブをパラフィルムで覆い、ラックを振って混合し、室温で2時間インキュベートします。
**ステップ 7 **ストレプトアビジンをBSAフリーのアッセイバッファー(ストック溶液は25 mg/mL)で2 µg/mLに希釈します。インキュベーションが完了したら、エッペンドルフのリピーターピペッターとコンビティップを用いて各チューブに 1 mL ずつ分注します。
**ステップ 8 **反応混合物をろ過ユニットに移します。フィルターベースとフィルターブロックは新品でも再使用でもかまいません(洗浄方法については ILA 検出キットの添付文書を参照)。低真空でろ過します。
**ステップ 9 **ろ過ステップの間に、酵素試薬を 1 バイアルあたり 4 mL の BSA フリーアッセイバッファーで再構成します。酵素試薬の 1:10 希釈液を調製します(酵素試薬 1 倍希釈液+BSA フリーアッセイバッファー 9 倍希釈液)。
**ステップ 10 **ろ過ユニットのウェルが空になったら、各ウェルに Wash Buffer を 2 mL ずつ分注し、高真空でろ過します。真空を切ります。
**ステップ 11 希釈した酵素試薬を、エッペンドルフのリピーターピペッターとコンビティッ プを使って各ウェルに 1 mL ずつ分注し、低真空でろ過します。
**ステップ 12 **ろ過ユニットのウェルが空になったら、各ウェルに洗浄液を 2 mL ずつ分注し、高真空でろ過します。
**ステップ13 **ウェルが空になったら、真空を止め、スティックを読み取ります。
アッセイ特性評価
標準曲線
標準曲線の最低検量線は、バックグラウンドシグナルに対して 30~50μV/秒のシグナルの増加を生じるウシ IgG の濃度を計算することにより選択しました。この計算は負荷試験の結果に基づいて行われました(Threshold System Operator's ManualのILAセクションのSandwich Assay Optimizationを参照)。標準曲線の他の検量線は、最低検量線より 2 log(100倍)上の範囲に分布させました。二次方程式がデータを最もよく表しています(図 2 参照)。
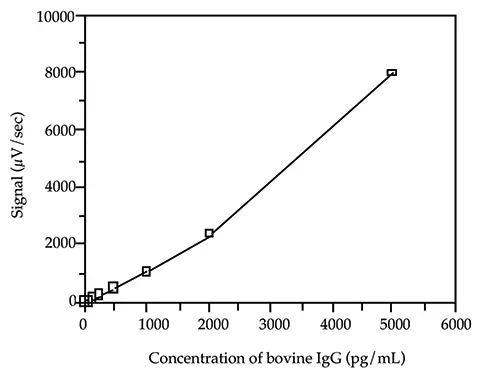
図2. ウシ IgG 標準曲線
インキュベーション時間
最適なインキュベーション時間を決定するため、速度論的研究を実施しました。ウシIgGの3つの標準曲線(5000、2000、1000、500、200、100、50、0 pg/mLのウシIgG)を標識抗体とともに4時間、1時間、30分間インキュベートしました。
4時間、1時間、30分のインキュベーションでは、同様のバックグラウンドシグナルが生じました。図3は、インキュベーション時間が長くなるにつれて勾配の増加が観察されたことを示しています。30分のインキュベーションで十分な感度と勾配が得られました。
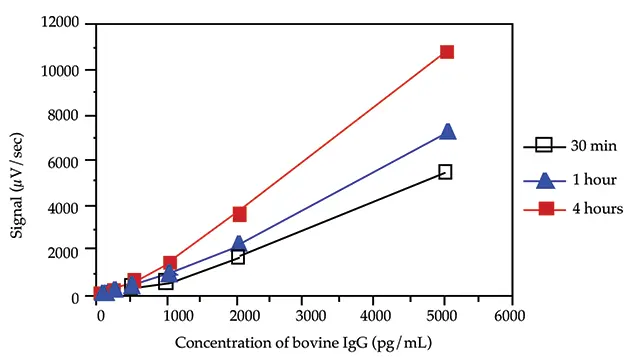
図3. インキュベーション時間の影響
検出限界
検出限界の評価については、Threshold System Operator's Manual を参照してください。このウシ IgG アッセイでは、50 pg/mL のウシ IgG をバックグラウンドから標準偏差 4 で検出できます(データは示していません)。
より迅速で感度の低いアッセイ
アプリケーションによっては、感度が低くアッセイ時間が短いウシ IgG アッセイを必要とする場合があります。インキュベーション時間を短くし、非標識ヤギ抗ウシ IgG 抗体を反応混合物に加えることで、標準曲線を ng の範囲にシフトすることができます。図 4 に、10 分間のインキュベーションで得られた標準曲線を示します。標識抗体(40 ng/test)を 400 ng/test の非標識抗体と混合しました。この抗体混合液の 100 µL を、異なる濃度の抗原を含むチューブに分注しました。標準曲線は 100~1 ng/mL の範囲でした。総測定時間は 1 時間でした。
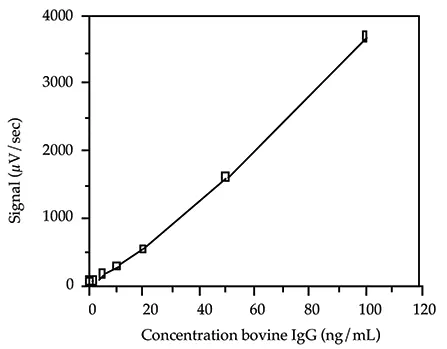
図 4. 高速アッセイプロトコルによるウシ IgG 標準曲線。
交差反応性
ウシ IgG はヒトやマウスなど他種の IgG と相同性を示す可能性があります。最も一般的な治療用抗体はモノクローナルヒトまたはマウスIgGです。本アッセイで使用する抗ウシ IgG 抗体は、アッセイ中に産生抗体と反応し、真のウシ汚染物質ではなく、むしろ種間交差反応性を示す陽性シグナルを生成する可能性があります。
マウスIgGとの交差反応性の可能性は、一定濃度のウシIgGの存在下または非存在下で、様々な量のマウスIgG(交差反応性コントロールと呼ばれる)を反応させることにより評価しました。サンプル抗体が細胞株から作製されたモノクローナル抗体である場合、最良の交差反応性コントロールは、マウス腹水から精製され、ウシIgGを含まないことを確認した産物抗体でしょう。これが入手できない場合、交差反応性コントロールは、分析する検体抗体にできるだけ類似しているが、ウシのコンタミネーションがないものを使用する必要があります。
ある実験では、分析するサンプル抗体は組換え細胞株から精製したモノクローナル マウス IgG1 でした。交差反応性コントロールはマウスから単離したポリクローナルマウスIgG1でした。ポリクローナル交差反応性コントロール抗体は、1000pg/mLのウシIgGの存在下または非存在下で、4つの濃度(11.3mg/mL、2.3mg/mL、1.1mg/mL、0.23mg/mL)で試験されました。交差反応性の割合は比較的高くありました(約5~10ppm:総量1mgのポリクローナルネズミIgGに対して、5~10ngが抗ウシIgG抗体と交差反応していました)。ポリクローナルなマウスIgGとポリクローナルな抗ウシIgGの間のこのような交差反応性は驚くべきことではありません。幸いなことに、治療用抗体のサンプルは通常モノクローナルであり、交差反応性が起こる確率は非常に低いです。
このことを別の実験で検証するために、交差反応性のコントロールはマウスの腹水から精製したモノクローナルなマウスIgG1としました。約1ng/mLのウシIgGの存在下または非存在下で、4種類の濃度の交差反応性コントロールモノクローナルウサギIgG1を試験しました(10mg/mL、2mg/mL、1mg/mL、0.2mg/mL)。アッセイ結果を図5に示します。
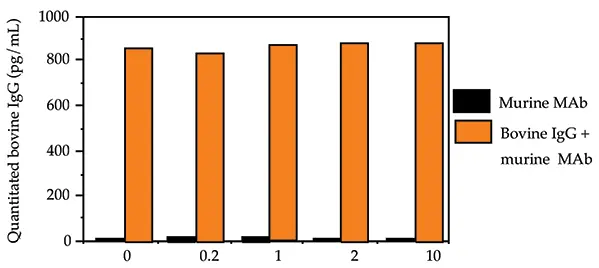
図5. ウシ IgG とモノクローナル マウス IgG1 の交差反応性。
モノクローナル マウス IgG1 の交差反応性コントロールの定量値は、ウシ IgG スパイクの非存在下で試験した 4 濃度すべてにおいて検出限界以下でした。1ng/mLのウシIgGの存在下では、交差反応性コントロールの定量値は、4つの濃度すべてにおいて緩衝液コントロール(0mg/mLの交差反応性コントロール)の定量値に匹敵しました。ポリクローナル抗ウシIgG抗体はモノクローナルウシIgGには結合しません。試験したモノクローナル マウス IgG1 サンプルとウシ IgG との間には交差反応性はありません。
ヒト抗体との交差反応性の可能性は、ヒト血液から単離したポリクローナルヒトIgGを用いて評価しました。ウシの汚染物質と接触していないモノクローナルヒト抗体は入手できませんでした。4種類の濃度のポリクローナルヒト交差反応性コントロール(17.6 mg/mL、3.5 mg/mL、1.8 mg/mL、0.4 mg/mL)を、1 ng/mLのウシIgGの存在下または非存在下で試験しました。交差反応性は0.8ppmであった:総量1mgのヒトポリクローナル抗体コントロールから、0.8ngが抗ウシIgG抗体と交差反応しました。マウス抗体と同様に、モノクローナルヒト抗体の存在下では交差反応性の確率は有意に低くなると予想されます。
アプリケーション
本アッセイの性能は、様々なタンパク質サンプルを試験することで評価しました。サンプルはノンスパイクおよび約 1 ng/mL のウシ IgG をスパイクして試験し、スパイク回収率 (SR) は以下のように算出した:
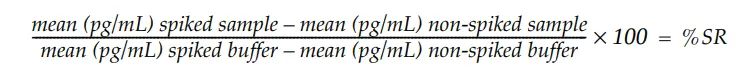
許容可能なスパイク回収率は100%+20%と定義されます。許容可能なスパイク回収率は、検体がウシIgGの測定に干渉せず、検体中のウシIgGの定量が正確であることを意味します。
BSAサンプル
BSAの2つの供給源について、通常のプロトコールアッセイで汚染ウシIgGの検査を行いました。BSA が緩衝液や培地の調製に使用されている場合、IgG 濃度が注目されることがあります。元のサンプル濃度は840 µg/mL(サプライヤー#1)と930 µg/mL(サプライヤー#2)でした。どちらの BSA サンプルも、非スパイクおよび約 1 ng/mL のウシ IgG をスパイクして検査しました。サプライヤー#1のBSAは1:10希釈で、サプライヤー#2のBSAは1:100希釈で検査しました。
| サンプル | スパイクされたサンプル(pg/mL) | スパイクされなかったサンプル(pg/mL) | ネットスパイク(pg/mL) | 実測値(ng/mg BSA) | % スパイク回収率 |
|---|---|---|---|---|---|
| BSAフリーアッセイバッファー | 927 | 13 | 914 | ||
| BSAサプライヤー#1 | 1357 | 444 | 913 | 5.2 | 100% |
| BSA サプライヤー #2 | 1328 | 544 | 784 | 58.5 | 86% |
表 3: 通常のウシ IgG 測定プロトコルを用いた BSA 溶液の結果。
BSA溶液には、サプライヤー#1ではBSA 1 mgあたり5.2 ngの汚染ウシIgGが、サプライヤー#2ではBSA 1 mgあたり58.5 ngの汚染ウシIgGが含まれていました。このウシIgGアッセイにより、2つの異なる業者のBSA純度を比較することができます。
このアッセイにおけるBSAサンプルの陽性反応は、2つの現象による可能性があります:BSA溶液に混入したウシIgG、および/またはこのアッセイで使用した抗ウシIgG抗体中の混入抗BSA抗体の存在です。第二の可能性は、BSA溶液中の実際のウシIgG汚染に比べればわずかかもしれないが、考慮すべきです。ヤギの免疫に使用したウシIgG免疫原がBSAで汚染されている場合、ヤギから精製した抗ウシIgG抗体には抗BSA抗体が含まれます。これらの抗体はアッセイ中にサンプルのBSAと反応します。これらの潜在的な問題は、抗 BSA 抗体を飽和させるか、モノクローナル抗ウシ IgG 抗体を使用することで取り除くことができます。
子牛胎児血清
子牛胎児血清(FCS)は、通常のプロトコールアッセイでウシ IgG を検査しました。子牛胎児血清中のウシIgGを定量することは、血清が細胞培養培地の調製に使用される場合に興味深いです。試験した各希釈液(10-3~10-7)は、ノンスパイクおよび約 1 ng/mL のウシ IgG をスパイクして試験しました。
| サンプル | スパイクされたサンプル(pg/mL) | スパイクされなかったサンプル(pg/mL) | ネットスパイク(pg/mL) | 実測値(ng/mg BSA) | % スパイク回収率 |
|---|---|---|---|---|---|
| BSAフリーアッセイバッファー | 773 | 19 | 754 | ||
| 10 -3 |
15497 | 15002 | ** | - | - |
| 10 -4 |
2711 | 1935 | 776 | 19 | 103% |
| 10 -5 |
975 | 165 | 810 | 17 | 107% |
| 10 -6 |
786 | 10 | 776 | * | 103% |
| 10 -7 |
777 | 12 | 765 | * | 101% |
表 4: 通常のウシ IgG 測定プロトコルを用いて得られた子牛胎児血清の結果。
** 標準曲線を超える定量。* この希釈率では検出可能なウシIgGはありません。
検査した子牛胎児血清には平均 18 µg/mL のウシ IgG が含まれていました。
マウスIgGサンプル
マウス IgG1 サンプルについて、通常のプロトコール(1:50 および 1:100 希釈で検査)で汚染ウシ IgG を検査し、高速で感度の低いアッセイプロトコール(ニートで検査)で比較しました。元のサンプル濃度は14 mg/mLのマウスIgG1でした。
| サンプル | スパイクされたサンプル(pg/mL) | スパイクされなかったサンプル(pg/mL) | ネットスパイク(pg/mL) | 実測値(ng/mg BSA) | % スパイク回収率 |
|---|---|---|---|---|---|
| BSAフリーアッセイバッファー | 835 | 0 | 835 | ||
| Murine IgG 1 1:50 |
1727 | 763 | 964 | 38 | 115% |
| Murine IgG 1 1:100 |
1243 | 336 | 907 | 34 | 109% |
表5: 通常のウシIgGアッセイプロトコルを用いたマウスIgG1サンプルの結果。
通常のアッセイプロトコルを使用した場合、サンプル中に検出されたウシIgGの平均濃度は36 ng/mLで、これは2.6 ppm(マウスIgGサンプル1 mg中に2.6 ngのウシIgG)に相当します。同じサンプルを、感度の低い迅速アッセイできちんと検査したところ、汚染ウシIgG濃度は31 ng/mLで、これは通常のプロトコールアッセイで得られた結果と同等でした。腹水から作製したコントロールのモノクローナルマウス抗体は、この抗体サブクラスについてウシとマウスの交差反応性を示さなかったので、この量はウシIgGの実際の混入量を表しています。
アッセイ精度
マウスIgG1サンプルは、日ごとの再現性を調べるために、6つの異なる日に3連試験しました。同じ実験内での再現性は、6つの複製を試験することで調べました。試料の最終濃度は 0.28 mg/mL でした。以下の表に得られた結果を示します。
| アッセイ内再現性 | 日間再現性 | ||
|---|---|---|---|
| 日間 | 定量(pg bov. IgG/mL) | 日間 | 定量(pg bov. IgG/mL) |
| 1 | 679 | 1 | 717 |
| 664 | 2 | 732 | |
| 694 | 3 | 685 | |
| 712 | 4 | 743 | |
| 702 | 5 | 684 | |
| 692 | 6 | 679 | |
| 平均値 | 691 | 平均値 | 707 |
| 標準偏差 | 17 | 標準偏差 | 28 |
| C.V | 2.5% | C.V | 4.0% |
表 6: 牛 IgG 測定法の再現性および反復性。
概要
本アプリケーションノートのデータは、インキュベーション時間 1 時間、各標識抗ウシ IgG 抗体 40 ng/test で作成されています。これらの条件により、ウシ IgG のダイナミックレンジは 2 log(100倍)、検出限界は 50 pg/mL となります。インキュベーション時間を短縮してより迅速なアッセイを行うことも、より高感度なアッセイを行うためにインキュベーション時間を長くすることもできます。アッセイ性能のバリデーションは、試験する製品ごとに決定する必要があります。
PDF版(英語)