Application Note SpectraMax Plus 384マイクロプレートリーダーを用いた
ワイン中のL-リンゴ酸測定
- 従来のシングルチューブアッセイに比べてスループットが向上
- ワインサンプル中の分析対象物質を直接定量
- SoftMax Pro ソフトウェアで結果を自動計算
PDF版(英語)
はじめに
リンゴ酸、残糖、揮発性酸度、アンモニアの分析は、ワイン生産の品質管理にとって非常に重要です。マイクロプレートフォーマットで実施される酵素アッセイは定量的であり、時間と労力に関して高いスループットを達成するのに役立ちます。これらのテストは、副産物としてNADHを与える分析物の酵素的変換を伴います。340nmの吸光度を測定してNADH生成を測定することで、ワインサンプル中の分析物を直接定量することができます。ここでは、モレキュラーデバイス SpectraMax® Plus 384 マイクロプレートリーダーとSoftMax® Pro ソフトウェアを使用して、ワイン中の残糖を酵素法による定量でデータを効率的に収集・分析する方法についてご説明します。
SpectraMax Plus 384 マイクロプレートリーダーの独自機能は以下の通りです:
- 波長範囲 190-1000 nm、1 nm単位、フィルター不要
- 読み取り速度:96ウェル:9秒
- 384ウェル:29秒
- 温度 周囲温度より4℃高い温度から45℃まで
- キュベットポート 標準キュベットおよび12 x 75 mm試験管を収納可能
- OD範囲 0-4 OD
酵素法によるワイン中のリンゴ酸測定(MAD)
酵素反応:
(1)L-(-)-Malic adic + NAD+
Oxaloacetate + NADH+ H+
(2) Oxaloacetate + L-Glutamate
L-Aspartate + a-Ketoglutarate
LMDH:LMDH: L-Malic Dehydrogenase
GOT:GOT: Glutamate-Oxaloacetate Transaminase
ダイナミクス反応
平衡反応(上記の反応1)は、反応物(L-リンゴ酸とNAD+)の方に有利です。この反応における反応物の生成は、生成物(L-アスパラギン酸とa-ケトグルタル酸)の生成を有利にする第二の反応とカップリングさせることによって阻止されます。NADHの生成はL-リンゴ酸の酸化と化学量論的に関連しているので、L-リンゴ酸の測定は340 nmにおけるNADHの吸光度によって決定することができます。
PathCheckセンサー
PathCheckセンサーは、マイクロプレートウェル内のサンプルの光路長を測定する、モレキュラーデバイスの温度に依存しない機能です。マイクロプレートウェルの吸光度を1cmキュベットの吸光度に正規化する画期的な方法です。
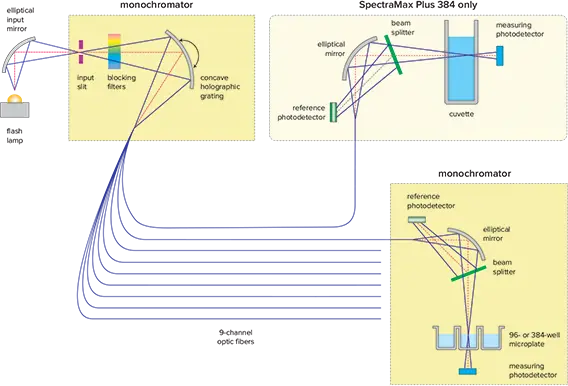
図1. SpectraMax® Plus 384光学機能
ランベルト・ベールの法則は、次のように定めています。
吸光度 = E * C * L
ここで
E = 吸光度(消衰係数)
C = 濃度
L = 光路長
キュベットの場合、光路は水平なので、光路長は固定され、1cm に等しいです。しかしマイクロプレートの場合、光路は垂直です。そのため、光路長はサンプルの体積に依存します(図2)。PathCheckセンサーはこの不一致を補正します。

図2. キュベットとマイクロプレートでは経路長が異なる。
SoftMax Pro ソフトウェア
ソフトウェアが機器を制御し、データを収集し、完全なデータ解析を行います。適切な機器設定と計算を含むカスタマイズされたプロトコルは、事前に作成して保存できます。エンドユーザーは、設定済みのプロトコルを開くだけで、プロトコル設定時間なしに、完全な結果と解析を得ることができます。
材料
- SpectraMax Plus 384 マイクロプレートリーダー(モレキュラーデバイス #PLUS 384)
- 試薬添加用UV透明96ウェルマイクロプレート (Costar)
- トランスファーペットマイクロピペット(Drummond Scientific; Drummond Digital Microdispenser)
- マイクロピペット用マイクロチップ (Eppendorf ; Reloads)
- マイクロフュージチューブ用遠心分離機(Eppendorf)
- 容量1.5 mLマイクロフュージチューブ(Eppendorf)
- L-Malic Dehydrogenase 25 mg/5 mL (LMDH、Roche)
- グルタミン酸-オキサロ酢酸トランスアミナーゼ 2 mg/mL (GOT, Roche)
- ß-Nicotinamide-Adenine Dinucleotide (NAD, Roche)
- グリシル-グリシン (Sigma)
- L-グルタミン酸(Sigma)
- 2.5NのKOH(フィッシャーサイエンティフィック)

図3. ワイン中のリンゴ酸測定(MAD)
| Concentration | 0.1 g/L | 0.5 g/L | 1.5 g/L |
|---|---|---|---|
| DI H2O | 95 mL | 95 mL | 95 mL |
| リンゴ酸 | 0.001 g | 0.005 g | 0.15 g |
表1. L-リンゴ酸標準物質の調製。
方法
L-リンゴ酸標準試薬の調整
試薬は溶解するまで撹拌しました。標準物質が決定係数(R)=1.000の標準曲線を示した場合、1.5mLの凍結チューブに入れ、-4℃で保存しました。試薬が古すぎると理想的な標準曲線が得られないことがあります。
緩衝液の調製
70mLの脱イオン(DI)H2Oに15.0gのグリシルグリシン、30.0gのL-グルタミン酸、67mLの2.5N KOHを加えました。2.5NのKOHでpHを10.0に調整しました。この溶液の容量をメスフラスコで500mLに調整しました。緩衝液は4℃で保存しました。
ステップ1:ブランク、標準品、サンプルを二重測定しました(表2)
| 試薬ブランク | バッファー 300 µL | 純水 5 µL |
|---|---|---|
| スタンダード | バッファー 300 µL | スタンダード 5 µL |
| サンプル | バッファー 300 µL | サンプル 5 µL |
表2. ブランク、標準品、試料の調製。
ステップ2:L-リンゴ酸標準物質を冷凍庫から取り出し、室温まで温めました。
ステップ3:標準品とサンプルの分析に必要な量のバッファーを専用の「MAD」ビーカーに計量し、室温に温めました。このステップは、理想的な決定係数を得るために必要です。
ステップ4:表3に従って、GOTとNADを緩衝液に加えました。GOTとNADは、酵素を変性させないよう、十分に、しかし穏やかにバッファーに混合しました。
| バッファー必要量 | GOT添加量 | NAD添加量 |
|---|---|---|
| 105 µL | 10 µL | 0.024 g |
| 50 mL | 35 µL | 0.12 g |
| 100 mL | 70 µL |
0.24 g |
| 150 mL | 105 µL | 0.36 g |
| 200 mL | 140 µL | 0.48 g |
| 250 mL | 175 µL | 0.60 g |
表3. 反応バッファーに加える必要のあるGOTとNADの計算。
ステップ5:300μLマルチチャンネルピペットを用いて、各ウェルに300μLの緩衝液を分注しました。
ステップ6:5µLのDI H2O、標準品、またはサンプルを適切なウェルに分注しました。
ステップ7:試薬を上下にピペッティングして混合しました(トリチュレーション)。
ステップ8:プレートを30秒間ボルテックスして混合し、マイクロプレートリーダーで吸光度を測定しました。
ステップ 9: 最初の読み取り値の直後に、1-20 µL マルチチャンネルピペットを用いて、各ウェルに LMDH を 5 µL ずつ分注しました。
ステップ 10: プレートを30秒間ボルテックスして混合し、室温で21分間インキュベートしました。
ステップ 11:21 分間インキュベートした後、マイクロプレートリーダーで、同じ装置設定で「最終」読み取りを行いました。
機器のセットアップ
装置はSoftMax Proソフトウェアでプログラムししました。設定はソフトウェアのプレートセクションで選択しました(図4)
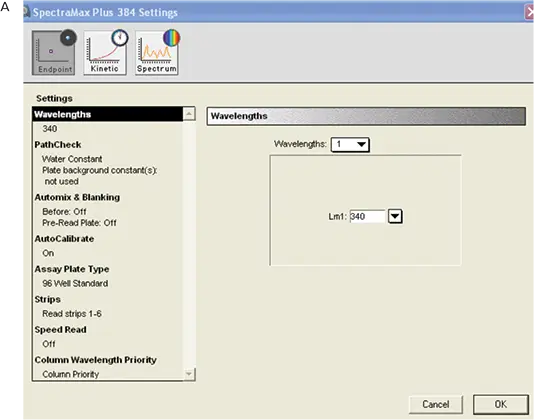
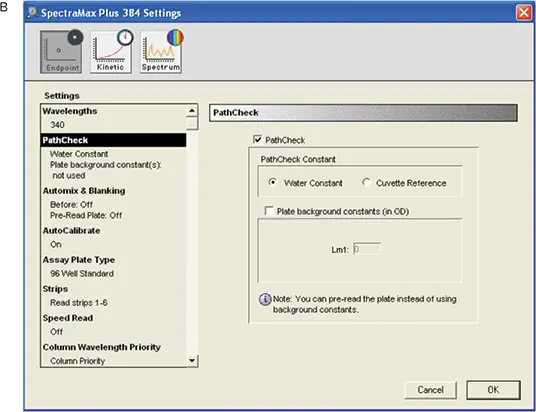
図4. MADアッセイの装置設定。A:全体的な設定 B:PathCheckの設定。
reading typeはendpoint。
wavelengthウィンドウに適切な数値を入力し、wavelengthを340nmに設定しました。
"PathCheck "オプションでwater constantを選択しました。反応は水環境で行われたため、機器のファームウェアに含まれるwater constantが使用されました。
混合はプレートシェーカー上で外部的に行われたため、自動混合は選択されませんでした。自動校正では、装置は選択されたwavelengthに対して自ら校正を行いました。
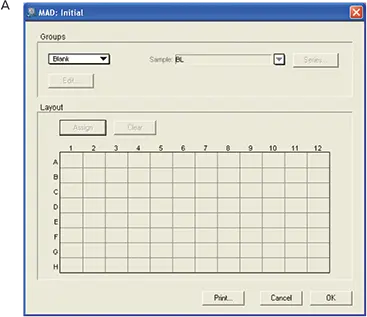
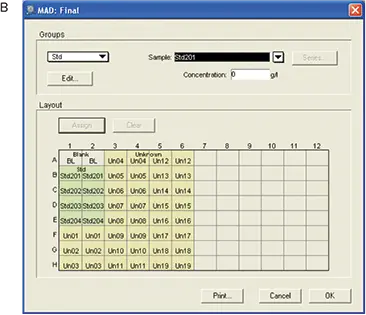
図5. MADアッセイ用のテンプレートのセットアップ。最初のプレートにはテンプレートをセットアップしなかったです。最終プレートのブランクには、標準品と未知検体を割り当てました。
適切なプレートフォーマットと読み取り対象のウェルが選択されました。
同じプレートセクションを2つ作成しました。最初のプレートセクションは、すべての試薬を含むが酵素を含まないプレートのreadingを行いました。最後のプレートセクションは、酵素を用いた実際の反応です。初期プレートセクションの光学密度測定値は、還元設定により最終プレートセクションの光学密度測定値から差し引かれました(図6)
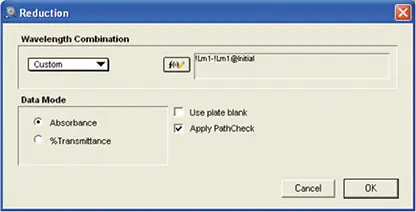
図6. MADアッセイ用のReductionセットアップ。最終プレートの同じウェルの光学濃度から初期プレートの各ウェルの光学濃度を差し引くために使用されるカスタム式を示すReductionセットアップ。計算にはPathCheck値が適用されました。
結果
実験は「材料と方法」のセクションに記載したように行いました。酵素を除く反応混合物を含むプレートでベースラインのreadingを行いました(図7、パネルA)。反応混合物に酵素を加えた後、プレートを室温で21分間インキュベートし、最終的な読み取りを行いました(図7、パネルB)
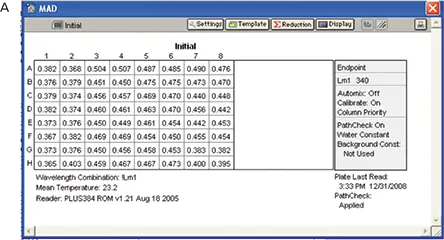
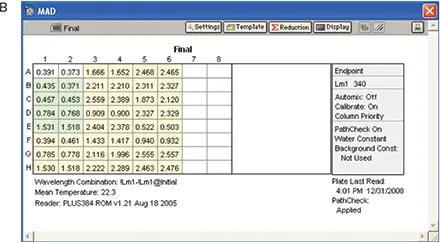
図7. MADアッセイの結果。すべての試薬を添加し、酵素を添加しない状態で読み取ったプレート(A)と、酵素を添加してインキュベートした後に読み取ったプレート(B)
SoftMax Proソフトウェアは、標準物質の平均、標準偏差、%CVを自動的に計算し、グループセクションに集計しました(図8)
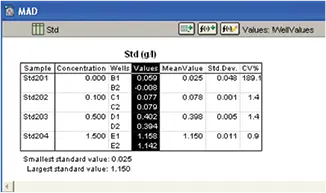
図8. 規格に関する計算。平均値、標準偏差、%CVの計算を伴う標準群セクション。
Standard curve
Standard curveは、グループセクション "Std "の情報を用い、X軸に濃度、Y軸に反復試料の平均OD値をとって作成しました。Standard deviationはエラーバーに使用され、プロットには線形曲線フィットが割り当てられました。このStandard curveは、"Unknown "と表示されたワインサンプル中のL-リンゴ酸濃度の測定に使用されました(図9)
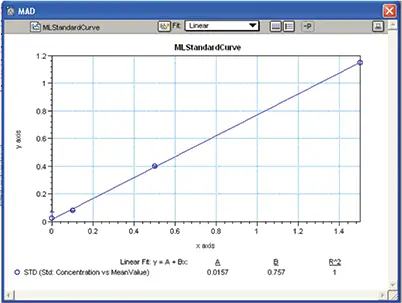
図9. MAD測定Standard curve。Standard curveは一次曲線フィットでプロットされ、ワインサンプル中のリンゴ酸濃度を導き出すために使用されました。
ワインサンプル中のL-リンゴ酸濃度測定
テンプレートセクションのワインサンプルのウェルの割り当てに従って、"Unknown "と指定されたグループセクションが形成されました(図10)
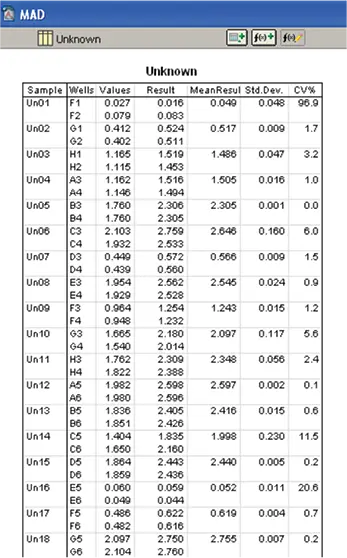
図10. ワインサンプル中のリンゴ酸濃度の計算。ワイン試料中のリンゴ酸濃度は標準曲線を用いて算出しました。
各サンプル中のリンゴ酸は、standard curveを用いてソフトウェアにより算出されました(図11)
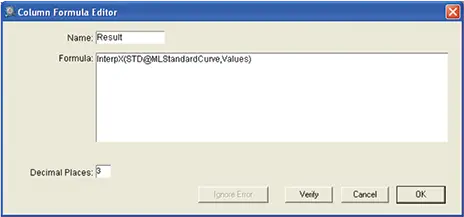
図11. standard curveを補間するためのカスタム式。"Unknown"グループ・テーブルの "Result "列の計算式で、standard curveからの補間によりワイン・サンプル中のリンゴ酸を自動計算。
結論
モレキュラーデバイス SpectraMax Plus 384 マイクロプレートリーダーは、ワイン中のL-リンゴ酸の酵素定量測定に最適です。
コストと時間の効率に優れています。
SpectraMax Plus 384マイクロプレートリーダーの調整可能性とPathCheckセンサー機能は、より高い精度と正確性を達成するのに役立ちます。
SoftMax Proソフトウェアは、複雑で大規模なデータセットの分析と計算に便利なツールです。あらかじめ書き込まれたすぐに使用できるプロトコール、カスタム式、適切なグラフ作成オプションが用意されています。
SpectraMax i3x マルチモードプレートリーダーなど、吸光度検出モードを備えた他のモレキュラーデバイス製プレートリーダーも、このアプリケーションに使用できます。
スループットの向上が必要な場合は、モレキュラーデバイス StakMax® マイクロプレートスタッカーをSpectraMax プレートリーダーと統合し、20、40、または50マイクロプレートのバッチ処理を自動化することができます。
マイクロプレートリーダーについてさらに詳しく >>
PDF版(英語)