Application Note 非連続的なキネティック測定による長期的な細胞増殖の評価
- キネティック測定の合間に装置を解放し、ラボの効率を向上
- 複数のデータポイントを自動的に結合し、キネティックグラフを生成
- SoftMax Proソフトウェアで異なる増殖条件を比較解析
PDF版(英語)
はじめに
多くの生物製剤実験では、長時間(数時間、数日、あるいは数週間)にわたってセル増殖のモニタリングや酵素変化の測定を行う必要があります。加えて、ある種のモデル生物は、マイクロプレートリーダーで長期間保存することができません。例えば藻類の培養は、生育を成功させるために定期的に光と高次の湿度に曝す必要があり、藻類の生育条件の比較研究は数週間にわたって測定されます *1。長期のカイネティック測定は、酵素動態、細胞シグナル伝達、タンパク質発現など、生物学の他の側面の研究にも利用できます。しかし、このようなアッセイをマイクロプレートリーダーで長期連続カイネティック測定すると、プレートリーダーを長時間占有することになり、ラボの効率が大幅に低下します。さらに、一連のエンドポイント測定を行うと、カイネティックプロットを作成するために手作業で連結しなければならないデータセットが得られます。
モレキュラーデバイスマイクロプレートリーダーとSoftMax® Proソフトウェアを使用することで、研究者はソフトウェアのInterrupt機能とAppend機能(図1)を使用して、長時間にわたって測定を行うことができるようになりました。これらの機能により、培地添加やその他の実験のためにマイクロプレートを装置から取り外し、カイネティック測定を再開することができます。
図1. カイネティック測定の追加 カイネティック測定は、Controls and Status パネルの測定中に Interrupt(中断)ボタンを押すことで中断できます。同じファイル内でカイネティック測定の収集を再開するには、Append ボタンを押します。
このアプリケーションノートでは、SpectraMax® iD3マルチモードマイクロプレートリーダーの不連続カイネティック測定プロトコルを使用して、24時間にわたって600 nmの吸光度(OD₆₀₀として報告)を測定する方法を示します。
材料
- 96ウェル底透明ポリスチレン製マイクロプレート (Greiner)
- BactoBeads™ 大腸菌 GFP ホスト (Edvotek)
- 溶菌ブロス(LB、Sigma Aldrich)
- アンピシリン(Sigma Aldrich)
- SpectraMax iD3マルチモードマイクロプレートリーダー (モレキュラーデバイス)
方法
OD₆₀₀値が0.32のアンピシリン耐性大腸菌のストックを、100μg/mLのアンピシリンを封じ込めた10mLのLBで10倍、100倍、1000倍に希釈しました。24時間にわたり、各細菌培養の100µLアリコートを96ウェルマイクロプレートの1ウェルに定期的に移し、SpectraMax iD3プレートリーダーとSoftMax Proソフトウェアを使用して600 nmの吸光度を測定することにより、OD₆₀₀の変化を測定しました。装置の設定を表1に示します。
| 読み取りモードの設定 | |
|---|---|
| Read mode | 吸光度 |
| 読み取りタイプ | カイネティック |
| 波長 | 600 nm |
| タイミング | 1回/10分間 |
表1. 細菌増殖曲線のデータ取得に使用したプレートリーダーの設定
カイネティック測定は時間ゼロで開始しました。カイネティック測定を中断するには、SoftMax® Proソフトウェアの「Controls and Status」セクションで「Interrupt」ボタンをクリックしました。装置は、一時停止する前に、選択した読み取り領域内の残りのウェルの読み取りを終了しました。その後、プレートをプレートリーダーから外しました。カイネティック測定の次の時点について、培養物から新しいサンプルセットを採取し、プレートをプレートリーダーに挿入しました。元のデータファイルを開き、"Append "ボタンをクリックして、カイネティック測定にさらにデータポイントを追加しました(図1)。Append機能により、不連続な測定値が1つの連続した細菌増殖曲線に連結されました。細菌増殖条件を比較するために、SoftMax® Proソフトウェアで細菌増殖曲線のオンセット時間を計算しました。細菌培養が0.6 OD₆₀₀に到達するのに必要なオンセット時間を計算し、細菌増殖曲線の変曲点の傾きを計算するために、データ削減が設定されました(表2)。
| 細菌希釈 | 発症時間(分) | 変曲点での傾き |
|---|---|---|
| 10倍 | 1022 | 1.93E-05 |
| 100倍 | 1118 | 2.24E-05 |
| 1000倍 | 1175 | 2.46E-05 |
表2. 細菌細胞増殖のさまざまなパラメータ SoftMax® Proソフトウェアを使用すると、細菌増殖のさまざまな領域を分析できる。細菌が0.6 OD₆₀₀に達したときをオンセット時間としました。
結果
細菌培養は、ラグ期、対数期、定常期、死滅期の4つの段階を経て進行します *2(図2)。Methodsのセクションで説明した3つの異なる細菌培養から細菌増殖曲線を作成するのに十分なデータポイントを収集しました(図3)。このデータは、各培養物がラグ期、対数期、定常期を異なる時間で進行することを示しています。装置で測定される光散乱法は、個々の細胞よりもむしろサンプルの質量に関係するため、死滅期はグラフでは観察されません。死細胞は依然としてサンプル中の質量を占め、光散乱に寄与するため、OD₆₀₀ *3, *4
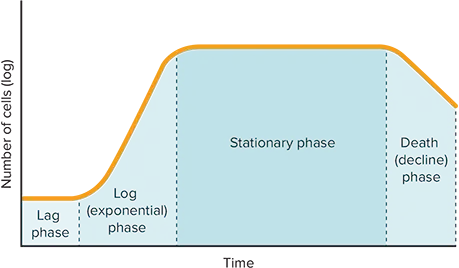
図2. 細菌の増殖段階 細菌増殖の4つの異なる段階を表します。
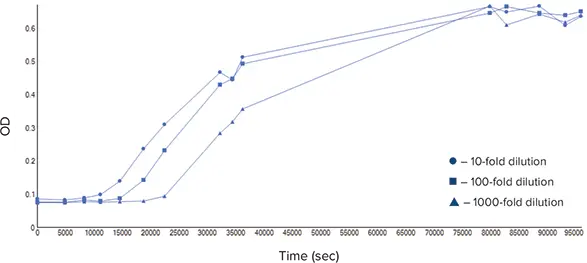
図3. 細菌増殖曲線 SpectraMax iD3プレートリーダーとSoftMax® Proソフトウェアを使用して、3種類の細菌希釈液を測定しました。測定は24時間にわたって行われた。ソフトウエアは、大きな時間差で区切られたデータポイントをリンクさせることができます。
SoftMax® Proソフトウェアを使用すると、細胞増殖のさまざまなパラメーターを計算できます。細菌培養がある光学密度に達したときの開始時間を計算することで、増殖速度を定量的に比較することができます。この例では、10倍に希釈した培養で最も早い開始時間が観察されました(表2)。より希釈度の低い培養物が最も短いオンセットタイムを持つだろうと予測したが、解析はそれを支持しました。
指数関数的成長の期間を反映する成長曲線の変曲点の傾きも、SoftMax Proソフトウェアのデータ削減機能を使用して計算することができます(表2)。
結論
細胞増殖をモニターする実験は、その長さに大きなばらつきがあり、1つの実験が何時間も何日もプレートリーダーを占有することを期待するのは非現実的です。SoftMax Proソフトウェアの不連続カイネティクス機能により、研究者はマイクロプレートリーダーを占有し続けることなくカイネティック測定を行うことができます。さらに、厳密に制御された環境条件を必要とする繊細な細胞タイプも、細胞の健康や生存に影響を与えることなく測定できます。最後に、異なる増殖条件を定量的に比較するために、SoftMax Proソフトウェア内で計算式とデータ削減を設定し、さまざまな解析を実行することができます。計算式の書き方については、当社の技術サポートにお問い合わせください。
参考文献
- Watanabe, Mariyo F., and Shinshi Oishi. “Effects of environmental factors on toxicity of a cyanobacterium (Microcystis aeruginosa) under culture conditions.” Applied and Environmental Microbiology 49.5 (1985): 1342-1344.
- Zwietering, M. H., et al. “Modeling of the bacterial growth curve.” Applied and Environmental Microbiology 56.6 (1990): 1875-1881.
- Sutton, Scott. “Measurement of microbial cells by optical density.” Journal of Validation Technology 17.1 (2011): 46.
- Maier, Raina M. “Bacterial Growth.” Environmental Microbiology. Edition 3. 37-54. Elsevier Inc. Web. 2009.
SoftMax Proソフトウェアについて詳しくはこちら >>
PDF版(英語)