Application Note SpectraMax iD3を用いた
セルヘルス評価と生存率アッセイ
- SpectraMax iD3 マルチモードマイクロプレートリーダーに最適化されたアッセイで、アッセイ開発の時間を短縮します
- シンプルで均一なワークフローにより、細胞の取り扱いを最小限に抑えます
- SoftMax Proソフトウェアの事前設定済みプロトコールにより、データ解析を効率化します
PDF版(英語)
はじめに
セルヘルスを細胞生存率やアポトーシス経路といった複数の観点から測定することで、薬剤候補、経路活性化剤や阻害剤、レポーター遺伝子など、さまざまな実験処理の影響について洞察を得ることができます。
セルヘルスを評価する最も一般的な方法のひとつは、マイクロプレートリーダーを用いた蛍光検出です。本テクニカルノートでは、SpectraMax® iD3 マルチモードマイクロプレートリーダー上でEarlyTox™ Cell Viabilityアッセイキット群を使用した事例をご紹介します(図1)。
図1. 細胞生存率アッセイの代表的な実験ワークフロー。
EarlyTox Live/Deadアッセイキット
このキットには、哺乳類細胞で使用可能な生細胞および死細胞の2種類のマーカーが含まれています。Calcein AMは広く使用されている生細胞マーカーです。非蛍光性のCalcein AMは、細胞膜を透過し、細胞内エステラーゼによって蛍光性のCalceinに変換されます。生細胞は細胞質で強い緑色蛍光を示します。細胞増殖アッセイや、生細胞のみの染色が必要な場合には、Calcein AMをEarlyTox™ Live Cellアッセイキット(Explorerキット:P/N R8342、Bulkキット:P/N R8343)に含まれる単独試薬として使用できます。
Ethidium homodimer-III(EthD-III)は、ほぼ非蛍光性であり、健全な細胞膜を透過しません。細胞死に関連する細胞膜の損傷が生じると、EthD-IIIは細胞内に侵入し、核酸に結合して死細胞に明るい赤色蛍光を発します。細胞膜の損傷に影響を与える細胞毒性イベントは、この方法で正確に評価できます。
CalceinおよびEthD-IIIからの蛍光シグナルはSpectraMax iD3 マルチモードマイクロプレートリーダーで検出でき、SoftMax® ProソフトウェアのEarlyTox Live Dead事前設定済みプロトコールを使用して迅速に解析できます。
EarlyTox Glutathioneアッセイキット
このキットは、細胞膜透過性でGSHに高い親和性を持つ蛍光色素monochlorobimane(MCB)を使用し、細胞内GSHレベルを検出します。MCBとGSHの反応は、内因性のglutathione-S-transferase(GST)酵素によって触媒され、394 nmで励起、490 nmで蛍光を発する青色蛍光を生成します。蛍光強度は細胞内のGSH量に対応し、アポトーシスの進行に伴って増加します。代表的な競合アッセイとは異なり、EarlyTox Glutathioneアッセイは、細胞の回収や遠心、溶解などの時間を要する操作を行わず、マイクロプレートフォーマットで生きた細胞をそのまま使用できます。SoftMax Proソフトウェアでは、事前設定済みのEarlyTox Glutathioneプロトコールにより、機器設定と解析が簡略化されています。
EarlyTox Caspase-3/7 R110アッセイキット
EarlyTox Caspase-3/7 R110アッセイキットは、マイクロプレートリーダー用に特別に設計された単一ステップの均一アッセイを提供します。蛍光基質(Ac-DEVD)₂-R110には2つのDEVDコンセンサス配列が含まれており、細胞溶解液中の酵素によって2段階で完全に加水分解されます。両方のDEVDペプチドが加水分解されると、緑色蛍光色素rhodamine 110(R110)が放出され、490 nm励起、520 nm蛍光で大幅な蛍光増加が得られます。簡略化されたワークフローにより、通常この種のアッセイに必要な細胞数を減らし、複数ステップで生じるばらつきも低減します。SoftMax Proプロトコールライブラリには、事前設定済みのEarlyTox R110取得・解析プロトコールが含まれています。
材料
- EarlyTox Live/Deadアッセイキット
⚪︎エクスプローラーキット(2プレートサイズ、モレキュラーデバイス P/N R8340)
⚪︎バルクキット(10プレートサイズ、モレキュラーデバイス P/N R8341) - EarlyTox Glutathioneアッセイキット
⚪︎エクスプローラーキット(2プレートサイズ、モレキュラーデバイス)
⚪︎バルクキット(10プレートサイズ、モレキュラーデバイス) - EarlyTox Caspase-3/7 R110アッセイキット
⚪︎エクスプローラーキット(2プレートサイズ、モレキュラーデバイス P/N R8346)
⚪︎バルクキット(10プレートサイズ、モレキュラーデバイス P/N R8347) - HeLa細胞(ATCC)
- スタウロスポリン(Sigma)
- 96ウェル黒色透明底マイクロプレート(Corning)
- SpectraMax iD3マルチモードマイクロプレートリーダー
方法
細胞治療
HeLa細胞を黒色の透明底マイクロプレートに、1ウェルあたり20,000細胞、100 µLで播種しました。細胞は37°C、5% CO₂インキュベーターで一晩培養し、接着・増殖させました。その後、アポトーシスを誘導する処理を行いました。Live/Deadアッセイでは、staurosporineを10 µMから40 nMまで1:2の段階希釈で24時間処理しました。GlutathioneおよびCaspase-3/7 R110アッセイでは、staurosporineを5 µMから5 nMまで1:2の段階希釈で4時間処理しました。各濃度で4つのレプリケートを実施しました。
EarlyTox Live/Deadアッセイキット
Calcein AMとEthD-IIIのストック溶液をPBSに加え、各色素6 µMの濃度で2Xワーキング溶液を調製しました。各ウェルに100 µLの2Xワーキング溶液を添加し、最終容量200 µL、各色素の最終濃度3 µMとしました。プレートは室温で1時間インキュベートしました。その後、SpectraMax iD3 マルチモードマイクロプレートリーダーで、SoftMax Proソフトウェアの事前設定済みプロトコールを使用し、表1に示す設定でトップおよびボトムから測定しました。注:培地を除去し、Calcein AMとEthD-IIIの1X溶液を添加する操作は任意であり、必要に応じてバックグラウンド蛍光を低減できます。
SoftMax Proソフトウェアの事前設定済みEarlyTox Live Deadアッセイプロトコールは、緑/赤比を自動計算し、化合物濃度に対してプロットします。このプロトコールにより、必要に応じて実験細胞サンプル中の生細胞および死細胞の割合を算出できます。これらの計算には、アッセイプレートに追加のコントロールを設定する必要があります。
EarlyTox Glutathioneアッセイキット
10 mMのMCBストック溶液20 µLをPBS 10 mLに希釈し、20 µMのMCBワーキング溶液を調製しました。アッセイプレート中の細胞から培地を除去し、MCBワーキング溶液100 µLに置換しました。細胞は37°Cでインキュベートしました。試薬添加後1時間および2時間で、SpectraMax iD3プレートリーダーを用いて表1に示す設定で蛍光強度を測定しました。
| パラメータ | EarlyTox Live/Dead | EarlyTox Glutathione | EarlyTox Caspase-3/7 R110 |
|---|---|---|---|
| Read mode | 蛍光 | 蛍光 | 蛍光 |
| Read mode | エンドポイント | エンドポイント | エンドポイント |
| 波長 |
Lm1: Ex = 495 nm, Em = 530 nm Lm2: Ex = 530 nm, Em = 645 nm |
Ex = 394 nm, Em = 490 nm | Ex = 470 nm, Em = 520 nm |
| PMT and Optics | PMTゲイン: 自動 積分時間: 500 ms 下方測定を行う |
PMTゲイン: 自動 積分時間: 500 ms 下方測定を行う |
PMTゲイン: 自動 積分時間: 500 ms 下方測定を行う |
表1. SpectraMax iD3マルチモードマイクロプレートリーダーの設定 蛍光検出機能を持つ他のSpectraMaxプレートリーダーでも同様の設定が可能です。
EarlyTox Caspase-3/7 R110アッセイキット
酵素基質(Ac-DEVD)₂-R110(2 mM)を細胞溶解/アッセイバッファーに50 µL対1 mLの比率で加え、基質アッセイバッファーを調製しました。各ウェルに100 µLの基質アッセイバッファーを添加し、最終容量200 µL、基質の最終濃度50 µMとしました。サンプルは室温でインキュベートしました。試薬添加後1時間および2時間で、SpectraMax iD3プレートリーダーを用いて表1に示す設定で蛍光を測定しました。
結果
EarlyTox Live/Deadアッセイキット
Staurosporineで処理したHeLa細胞は明確な濃度依存性応答を示し、生細胞(緑色蛍光)と死細胞(赤色蛍光)のシグナル比として容易に定量化されました(図2)。全体として、RFU値は1時間インキュベートした細胞よりも2時間インキュベートした細胞で高くなりました(データ非表示)。4パラメータカーブフィットで算出したEC₅₀値は300 nMでした。
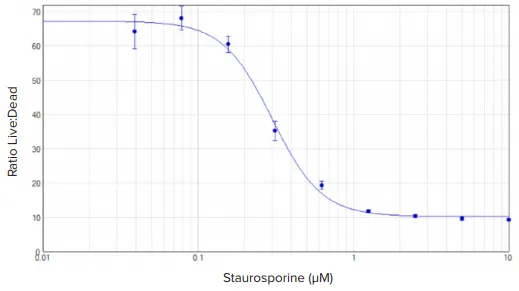
図2. EarlyTox™ Live/Deadアッセイ:staurosporineで24時間処理したHeLa細胞の濃度応答曲線 細胞はCalcein AMとEthD-IIIで1時間インキュベートしました。濃度曲線は、緑(530 nm発光)/赤(645 nm発光)のRFU比をY軸にプロットしました。SoftMax Proソフトウェアで4パラメータカーブフィットを適用。EC₅₀値は300 nM。
EarlyTox Glutathioneアッセイキット
Staurosporineで4時間処理したHeLa細胞は、EarlyTox Glutathioneアッセイで測定された細胞内グルタチオンの減少を示しました。SpectraMax iD3リーダーで、Staurosporine濃度の増加に伴う蛍光の減少が検出されました。結果はSoftMax Proソフトウェアで4パラメータカーブフィットを用いてグラフ化しました。蛍光強度は時間とともに増加しましたが、1時間および2時間のインキュベーションで得られたEC₅₀値はそれぞれ263 nMと295 nMでした(図3)。
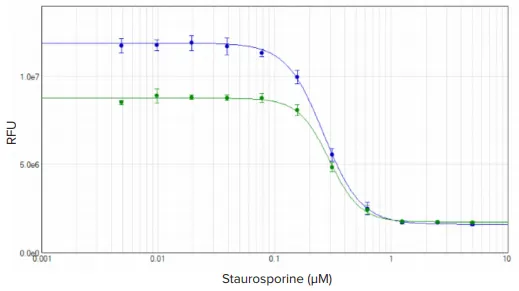
図3. EarlyTox Glutathioneアッセイ:スタウロスポリンで4時間処理したHeLa細胞の濃度反応曲線 細胞は試薬で1時間(緑プロット)または2時間(青プロット)インキュベートしました。濃度曲線はSoftMax Proソフトウェアで4パラメータカーブフィットを使用。EC₅₀値はそれぞれ263 nMと295 nM。
EarlyTox Caspase-3/7 R110アッセイキット
Staurosporineで4時間処理したHeLa細胞は、EarlyTox Caspase-3/7 R110アッセイで測定されたアポトーシス応答を示しました。SpectraMax iD3プレートリーダーでアポトーシス細胞に対応する蛍光が検出されました。結果はSoftMax Proソフトウェアで4パラメータカーブフィットを用いてグラフ化しました。基質で1時間または2時間インキュベートした細胞のEC₅₀値は、それぞれ193 nMと200 nMでした(図4)。
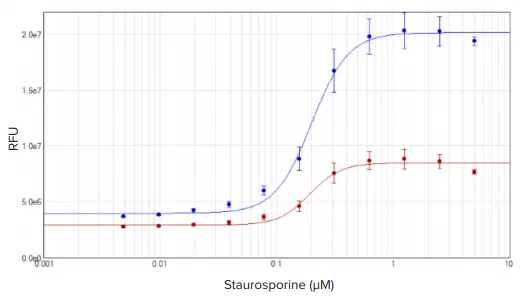
図4. EarlyTox Caspase-3/7 R110アッセイ:staurosporineで4時間処理したHeLa細胞の濃度反応曲線 細胞は試薬で1時間(赤プロット)または2時間(青プロット)インキュベートしました。濃度曲線はSoftMax Proソフトウェアで4パラメータカーブフィットを使用。EC₅₀値はそれぞれ193 nMと200 nM。
結論
SpectraMax iD3 マルチモードマイクロプレートリーダーとEarlyTox Cell Viabilityアッセイキットを組み合わせることで、マイクロプレートフォーマットによるシンプルなワークフローで、生細胞、死細胞、またはアポトーシス細胞を直接測定できます。時間を通じて一貫した結果が得られ、ワークフローの柔軟性が向上します。SoftMax Proソフトウェアの事前設定済みプロトコールは、最適化された機器設定を提供し、自動データ解析により結果取得までの時間を短縮します。
PDF版(英語)