Application Note FlexStation 3プレートリーダーを用いた、単波長および二波長インジケーターの
受容体媒介性細胞内カルシウム濃度([Ca²⁺]ᵢ)変化のモニタリング
- 細胞内カルシウム、膜電位、細胞内pHの測定など、カイネティックな細胞ベース蛍光アッセイ用の汎用プレートリーダー
- Gq共役型GPCRのモニタリングに使用されるカルシウム動員アッセイで、信頼性が高く再現性の高いデータを得ることができます
- 色素のレシオメトリック特性により、シグナルは5倍に増加します
PDF版(英語)
はじめに
FlexStation® 3 マルチモードマイクロプレートリー ダーは、高感度光学系、流体移動、温度制御を 統合しており、細胞内カルシウム、膜電位、細胞内 pHの測定などのカイネティック細胞ベース フルオロメトリックアッセイに最適です。
カルシウム(Ca2+)は、バクテリアから特殊な神経細胞まで、細胞内で最も一般的なシグナル伝達要素です。受容体-リガンド相互作用のような様々な事象が、細胞内カルシウム([Ca2+] i )濃度をⒶ~100 nMからⒷ~1 µMに上昇させ、これがシナプス伝達物質の放出、筋収縮、ホルモン分泌、細胞運動、アポトーシスを含む多くの事象の引き金となります。
[Ca2+] i )の変化は、Fluo-3やFLIPR® カルシウムアッセイキットなどの単波長色素またはFura-2などの二波長レシオメトリックインジケーターを用いて 測定することができます。単波長色素では蛍光強度はCa2+濃度に依存し、レシオメトリック指示薬ではCa2+濃度に比例したスペクトルシフトが起こります(図1)。Fluo-3のような最も一般的な単一波長インジケーターは可視光で励起され、最も一般的な二波長色素(Fura-2)はUV光を必要とします *2。
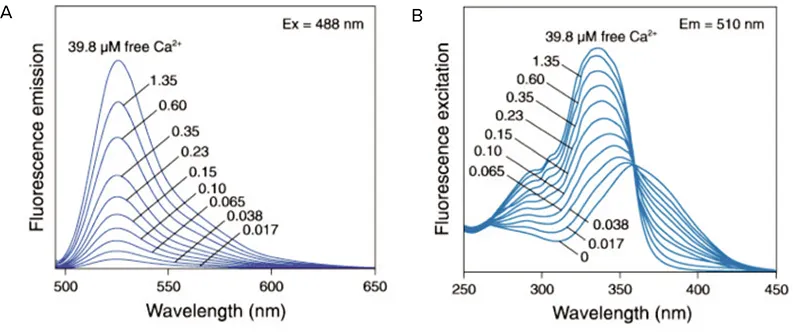
図1. Fluo-3の発光スペクトル。ゼロから39.8 µMの遊離Ca2+を封じ込めた溶液中でのFluo-3の蛍光発光スペクトル(A)とfura-2の蛍光励起スペクトル(B)。
** Molecular Probes Handbook of Fluorescent Probes and Research Chemicalsより転載。
FlexStation 3プレートリーダーには、調整可能なキセノンランプ ベースの光源とデュアル走査型モノクロメーターが組み込 まれており、機能的細胞アッセイに二波長色素を使用するこ とができます。可視光で励起可能なCa2+インジケーターは、サンプルの自動蛍光による干渉の低減や、色素による高い吸光度(より低濃度の色素の使用を可能にする)などの利点をご提供しますが、レシオメトリック色素は、従来の単一波長インジケーターよりもいくつかの利点をご提供します。Fura-2の340/380 nm励起比を使用する利点:
- シグナルは色素濃度、照明強度、光路長に依存しません。
- 色素の不均一な装填、色素の漏れ、光漂白の影響を最小限に抑えることができます。通常、蛍光を著しく失うことなく、1時間にわたって検出を行うことができます。
- より安定したシグナルと、より優れたシグナル-ノイズ比が得られ、感度が向上します。
- 細胞内Ca2+濃度の正確な測定が可能です。
別のアプローチとしては、FLIPRカルシウムアッセイキットなど、モレキュラーデバイスから入手可能な一連の「洗浄不要」試薬があります。これらもまた、従来のCa2+インジケーターに比べて多くの潜在的利点をもたらします。「無洗浄」試薬は、従来のアッセイプロトコルにおけるこれらの問題を軽減する可能性があります:
- 洗浄手順中にプレーティングから除去された細胞
- 洗浄後の細胞の反応性(コンピテンス)の低下
- 洗浄バッファー残量のばらつき、リード化合物濃度のばらつき
- 試験化合物の添加に伴う蛍光の低下(残存する細胞外色素の希釈によります)
このアプリケーションノートでは、FlexStation 3 プレートリーダーで一波長および二波長の Ca2+インジケーターを使用することと、ホモジニアスアッセイ システムの可能な利点を示します。
背景
血小板の調製
CHO-K1細胞には内因性ヌクレオチド受容体(P2Y2)*3,*4が存在し、ホスホリパーゼCの活性化、イノシトールリン酸(IP)の生成、プロテインキナーゼC(PKC)の活性化、細胞内Ca2+貯蔵の放出に関与しています *5。P2X受容体はATPゲートイオンチャネルであるのに対し、P2Y受容体はGPCRのスーパーファミリーに属します。P2Y受容体ファミリーには、P2Y1、P2Y2、P2Y4、P2Y6、P2Y11、P2Y12、P2Y13、P2Y14受容体が含まれます *6。P2Yサブタイプは、アデニンとウラシルのヌクレオチドに対する選択性において薬理学的に異なっており、P2Y2受容体に対する主な生理学的リガンドはUTPとATPです *7。P2Y2-受容体の重要な機能的役割の一つは、気道上皮における塩化物イオンのフラックスと肺の粘膜繊毛クリアランスの制御であり、嚢胞性線維症やその他の気道障害に関与している可能性があります。
P2Y受容体を標的とする新規リガンドは潜在的な治療薬で、そのような化合物を確実かつ再現性よくスクリーニングする能力は、FlexStation 3プレートリーダーを用いて実証されています。
Z'factor分析 *8とEC50推定値およびシグナルの大きさの比較を用いて、従来のCa2+インジケーターよりもレシオメトリックCa2+色素およびホモジニアスアッセイフォーマットの利点を示します。
材料
- 細胞 CHO細胞-接着細胞(ECACC)
- 試薬 FLIPR Calcium Assay Kit(モレキュラーデバイス)、ATP(アデノシン5'-三リン酸二ナトリウム塩、Sigma)、プロベネシド(Sigma)、DMSO、低含水(Sigma)、Fluo-3 AMエステル(Molecular Probes)、Fura-2 AMエステル(Molecular Probes)、20%プルロン酸溶液(Molecular Probes)
- プラスチック器具:75 cm 2培養フラスコ(Corning)、黒壁透明底96ウェルプレート(Costar)、透明U底96ウェルポリプロピレンプレート (Greiner Bio-One )、FlexStation用ピペットチップ - 200 μL非滅菌ポリプロピレンチップ(モレキュラーデバイス、黒色Cat. #9000-0911または透明Cat. #9000-0912)
- 培地とバッファー Hams-F12 培地(Invitrogen Life Technologies)、Hank's Balanced Salt Solution (10X)(Invitrogen Life Technologies)、HEPES 1M 緩衝液(Invitrogen Life Technologies)、FBS:(Fetal Bovine Serum, heat inactivated, Invitrogen Life Technologies)、Geneticin(G418、Invitrogen Life Technologies)
方法
Fluo-3およびFura-2試薬の調製
洗浄バッファー:このバッファーには、滅菌したd.H2Oで希釈した1X HBSSと20mM HEPESの最終濃度を封じ込めました。重要:陰イオン交換タンパク質による色素の押し出しを防ぐため、ローディング培地には2.5mMのプロベネシドを添加しました。
250mMのプロベネシドの新しいストックを調製します。710 mg のプロベネシドを 5 mL の 1 M NaOH に溶かし、5 mL の洗浄バッファー を加えて激しく撹拌します。
Fluo-3 と Fura-2 のストック溶液。50 µg の Fluo-3 AM または Fura-2 AM に 25 µL の DMSO を加えます(最終濃度 Ⓐ~2 mM)。
色素ローディングバッファー 25μLのFluo-3またはFura-2と25μLの20%プルロン酸溶液を混合し、これを2.5mMのプロベネシドを封じ込めた12mLの洗浄液に加え、120μLのFBSを加えます。これで96ウェルプレート約1枚分の試薬が調製できます。プルロニック酸は色素の溶解性と取り込みを促進するために使用されます。
FLIPR カルシウムアッセイキットの調製
キット添付の説明書に記載されているように、コンポーネント B を用いて 1X 試薬バッファー を調製し、コンポーネント A を 1X 試薬バッファーで希釈してローディングバッファーを調製します。
上記のように 250 mM Probenecid の新しいストックを調製します。
250 mM Probenecid の 1:50 希釈液を Loading Buffer(最終濃度 5 mM)に、250 mM Probenecid の 1:100 希釈液を 1X Reagent Buffer(最終濃度 2.5mM)に添加します。
細胞調製
CHO細胞(継代番号<40)を、10%ウシ胎児血清と5 µg/mL G418を添加しました。Hams-F12培地中で、75cm2のフラスコで細胞単層として培養し、CO2インキュベーター内で37℃に維持しました。細胞は2-3日ごとに1:10で継代しました。
[Ca2+] iの測定
CHO細胞を、上記のように添加したHams-F12培地中で、黒壁のクリアベース96ウェルプレート(96ウェルCostar社製)に1ウェル当たり3万個の密度で播種し、一晩培養しました。その後、細胞を適切なカルシウム指示薬(Fluo-3、Fura-2、FLIPR カルシウム測定キット)、および2.5 mMプロベネシドとともに37℃で60分間インキュベートしました(付録参照)。
Fluo-3またはFura-2を負荷した細胞は、2.5 mMプロベネシドを封じ込め たハンクスBSS培地で3回手動で洗浄しました(BioHit 8-channelピペット)。各ウェルの最終容量は200 µLでした。
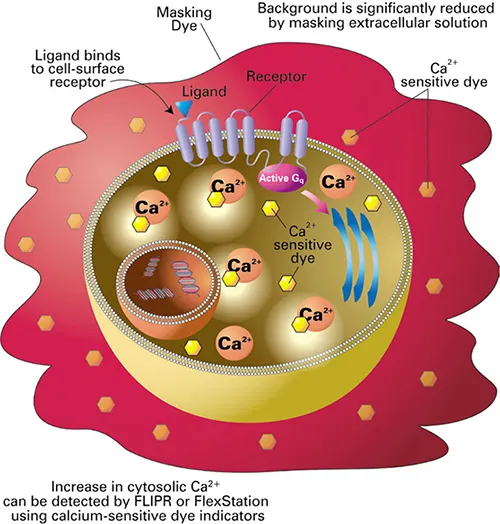
図2. FLIPRカルシウムアッセイの原理。FLIPRカルシウムアッセイキットにはカルシウム感受性色素が含まれており、インキュベーション期間中に細胞質内に取り込まれます。細胞不透過性のマスキング色素は細胞外に留まり、バックグラウンドの蛍光を遮断します。リガンドがレセプターに結合すると、カルシウムが細胞質内に放出されます。色素は細胞内カルシウムに結合し、蛍光の増加が測定されます。
次にセルプレートをFlexStation 3プレートリーダー にセットし、ATP添加前後の蛍光をモニターしました(50µL 添加、ATPは最終濃度5X、最終濃度30 nm- 30 µM)。実験パラメーターを以下に示します:
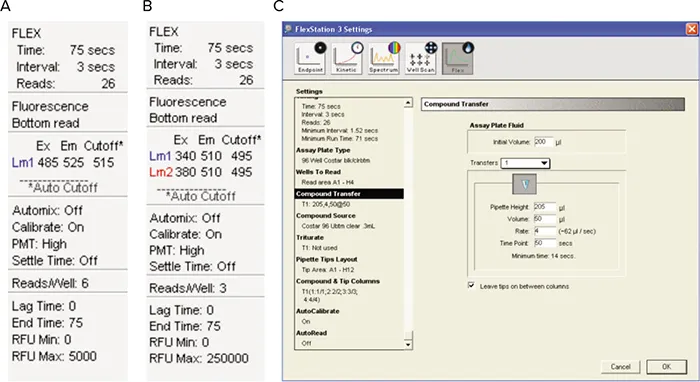
図3. SoftMax® Proソフトウェアの設定。(A)単一波長色素のみ、(B)Fura-2のみ、(C)All 3色素の実験パラメータ。
データ解析
反応は、ピーク蛍光強度から基底蛍光強度を引いた値(Fluo-3 または FLIPR カルシウム測定キット)、または Fura-2 の場合は SoftMax Pro 内で計算した 340/380 nm 励起比として測定しました。データはn > 12の平均±s.e.平均で表しました。
E/[A]カーブデータの個々のセットは、four-parameter logisticにfit処理した:
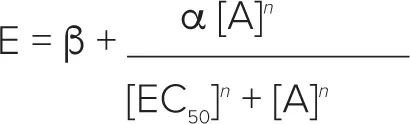
ここで、a、b、EC50 および n はそれぞれ、漸近線、曲線の底、位置(-log10 EC50 として表現)および傾きのパラメーターです。すべてのcurvefitting routinesは、GraphPad Prism 3.0(GraphPad Software)
Z´factorは次式で計算しました:
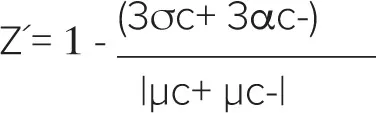
ここでσc+は陽性コントロールの標準偏差を表し、σc-は陰性コントロールの標準偏差を表します。μc+-μc-|は陽性コントロールの平均値と陰性コントロールの平均値の差の絶対値を表します。Z´ factor > 0.5は陰性コントロールと陽性コントロールの間に大きな分離帯があり、優れたアッセイであることを示します。
結果
ATPはCHO細胞において、濃度依存的に細胞内カルシウム濃度([Ca²⁺]ᵢ)を上昇させました(図4)。この反応に対するEC₅₀値は、Fluo-3、Fura-2、FLIPR カルシウムアッセイキットを用いた細胞間で類似していました(表1)。
一元配置分散分析(ANOVA)によると、EC50推定値は互いに有意差はなかったです(P値=0.62)。
| Fluo-3 AM | Fura-2 AM | FLIPR reagent | |
|---|---|---|---|
|
EC50 |
6.39 ± 0.12 | 6.44 ± 0.13 | 6.51 ± 0.07 |
| Signal (fold) | 1.8 X | 4.8 X | 5.6 X |
| Z’ factor | 0.28 | 0.60 | 0.68 |
表1. CHO細胞におけるATPのE/[A]曲線から算出された3つのパラメーター(EC₅₀、蛍光シグナルの増加倍率、Z’factor)の比較:各種Ca²⁺インジケーターを用いた場合。
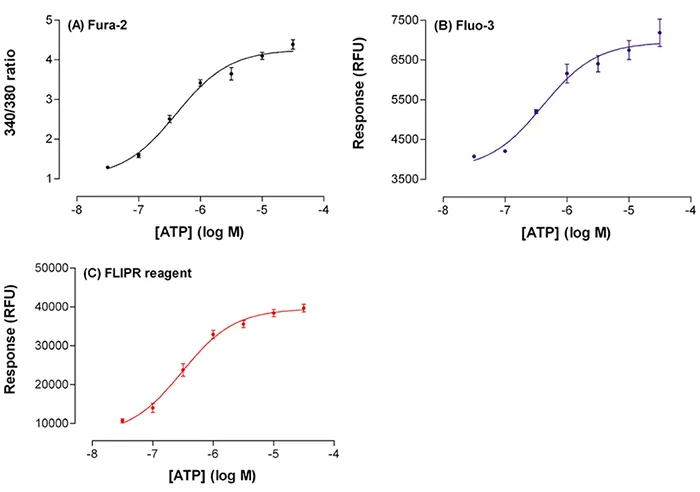
図4. 蛍光シグナルによるATPの増加。Fluo-3(B)とFLIPRカルシウムアッセイキット(C)、またはFura-2の340/380 nm励起比(A)を負荷した細胞の蛍光シグナルの増加(y軸)に対するATP濃度(x軸)のプロット。Fura-2比は、SoftMax® Proソフトウェアで時間補間したデータから算出しました。データは平均±s.e.平均。
これらの結果は、3種類の蛍光試薬を負荷した細胞からのATP EC50値に無視できるほどの差がないことを示しています。しかし、2つの単一波長試薬の蛍光強度のピークには有意な差がありました。Fluo-3では、シグナルが基底値より1.8倍増の3,200RFUになったのに対し、FLIPRカルシウムアッセイキットでは5.6倍増の32,000RFUになりました。ピーク反応はFluo-3ではより変動しやすい傾向がありました(図4参照)。Fura-2では、シグナルは基底値より4.8倍増加しました。
シグナルのダイナミックレンジとアッセイのデータ変動を反映するスクリーニング係数ウィンドウ(Z'factor)*8 は、バッファー添加(ネガティブコントロール)と 30 µM ATP 添加データ(ポジティブコントロール)を用いて計算しました。Fura-2とFLIPRカルシウムアッセイキットで得られたZ´factorはそれぞれ0.60と0.68でした(表1)。これは陰性対照と陽性対照の間に大きな分離帯があり、再現性の高い高品質なアッセイであることを示しています。Fluo-3のデータで得られたZ'factorは0.28で、「使用可能な」アッセイでしたが、これはおそらくアッセイのプロトコールが最適でなかったことと、その後のアッセイのダイナミックレンジが小さかったことを反映していると思われます。
結論
本研究では、P2Y2-受容体を内因的に発現するCHO細胞において、ATPは以前に報告されたものと同様の効力 をもって、濃度依存的に[Ca2+] iの増加を引き起こしました。さらに、FlexStation 3プレートリーダーを用いることで、このようなGq-共役GPCRをモニターするためのカルシウム動員アッセイにおいて、信頼性が高く再現性のあるデータを作成できることを実証しました。
ATPのEC50推定値は、蛍光色素Fluo-3(6.39)、Fura-2(6.44)、FLIPRカルシウムアッセイキット(6.51)のいずれを用いても同程度であり、同じ日のアッセイプレート間でも、異なる日に分析したアッセイ間でも一貫していました(0.6 log unit以下の差)。しかし、3つの異なるローディングプロトコールによるダイナミックレンジには有意差があり、これは対応するZ'factorに反映されています。細胞をFluo-3で負荷した場合、シグナルは基底値の2倍以下の増加しか観察されなかったですが、その最も可能性の高い原因は、プロトコルのその後の洗浄工程が細胞の反応性を低下させたことです。より低い継代番号の細胞を使い、専用の細胞洗浄器(AquaMax® Washerまたは同様のもの)を使えば、おそらくFluo-3を負荷した細胞のZ'factorは改善されたでしょう。これらの実験条件下で、Fura-2では、細胞が何度も洗浄ステップを経たにもかかわらず、シグナルが5倍増加しました。これは、この色素の有益なレシオメトリック特性によるものと考えられます。FLIPRカルシウムアッセイキットでシグナル、ひいてはZ'factorの最も大きな倍率の増加が観察されたことから、この「無洗浄」ホモジニアスアッセイが、より強いシグナル、より高いアッセイ精度、生理学的データの改善につながることが示されました。
FlexStation 3 プレートリーダーは、薬理学や薬剤スクリーニングのラボに使いやすく多用途のツールを提供し、細胞内カルシウム、膜電位、細胞内pHの測定のようなカイネティック、細胞ベースのフルオロメトリックアッセイに適していることが証明されています。
モレキュラーデバイスのホモジニアスアッセイキットは、アッセイにおけるより少ないステップで同じ目標を達成することが証明さ れていますが、FlexStation 3 プレートリーダーはレシオメトリック染料を使用できるため、データの忠実度の向上に役立ちます。
参考文献
- Berridge, M.J. (1997). Elementary and global aspects of calcium signalling. J. Physiol., 499, 291 - 306.
- Haughland, R.P. (2000). Molecular Probes Handbook of Fluorescent Probes and Research Chemicals. Chapter 20 – Indicators for Ca 2+ , Mg 2+ , Zn 2+ and Other Metal Ions.
- Endogenous GPCR List by Agi Schonbrunn, Ph.D. Department of Integrative Biology, Pharmacology and Physiology, University of Texas Health Science Center, Houston, Texas. (https://www.tumor-gene.org/GPCR/gpcr.html)
- Strassheim, D. and Williams, C.L. (2000). P2Y2 Purinergic and M3 Muscarinic Acetylcholine Receptors Activate Different Phospholipase C- Isoforms Are Uniquely Susceptible to Protein Kinase C-dependent Phosphorylation and Inactivation. J. Biol. Chem., 275, 39767- 39772.
- Conant, A.R. et al (1998). Characterization of the P2 receptors on the human umbilical vein endothelial cell line ECV304. Br. J. Pharmacol., 125, 357-364.
- Geoffrey Burnstock, Maria-Pia Abbracchio, Jean-Marie Boeynaems, José L. Boyer, Stefania Ceruti, Marta Fumagalli, Christian Gachet, Rebecca Hills, Robert G. Humphries, Kenneth A. Jacobson, Charles Kennedy, Brian F. King, Davide Lecca, Maria Teresa Miras-Portugal, Gary A. Weisman. (2010). P2Y receptors. IUPHAR database (https://www.iuphar-db.org/ DATABASE/FamilyMenuForward?familyId=52).
- Law, C., Lydford, S.J. & Henderson, D.J. (1998). Characterisation of the P2-receptor(s) on ECV304 endothelial cells using FLIPR. NaunynSchmeidebergs Arch. Pharmacol. 358, R126.
- Zhang, J-H., Thomas, T.D.Y. and Oldenburg, K. R. (1999). A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J. Biomol. Screening, 4, 67–73.
FlexStation 3 マルチモードマイクロプレートリーダーについてさらに詳しく>>
PDF版(英語)