Application Note 二重発光蛍光色素を用いたがん細胞株における
ミトコンドリア膜電位のモニタリング
- 自動化された蛍光イメージングと解析から生成されるマルチパラメトリックリードアウトにより、ミトコンドリア機能に対する化合物の影響を迅速に定量化
- 様々な細胞種におけるミトコンドリア膜電位の変化をモニター
- 化学物質/環境毒性スクリーニングと同様に、前臨床薬物安全性評価におけるミトコンドリア機能の有用性を強調
PDF版(英語)
はじめに
Heather Mary Brown, PhD | Application Scientist | Enzo Life Sciences
Matthew Hammer | Applications Scientist | モレキュラーデバイス
Cheryl L. Bell, PhD | Field Applications Scientist | モレキュラーデバイス
疾患の研究から薬物や環境化合物による毒性の評価まで、細胞の健康状態をモニターすることを目的とした細胞ベースアッセイは、しばしばミトコンドリアに焦点を当てています。パーキンソン病、アルツハイマー病、心不全、虚血性疾患、がんを含む様々な疾患とミトコンドリア機能不全の関連性によって強調されるように、ミトコンドリア機能は全体的な細胞の健康の重要な指標です *1。さらに、希少疾患の病因は、ミトコンドリアタンパク質をコーディングする遺伝子やミトコンドリアDNAの変異によって引き起こされることもあります *1。
ミトコンドリアの機能を評価することは、医薬品の開発や試験において非常に重要。このことは、ミトコンドリア機能を回復させる治療薬の開発や、がんにおけるミトコンドリア機能障害を標的とした化学療法薬の開発などに代表されます *3。さらに、ミトコンドリア機能障害は薬剤によって誘発され、ひいては細胞や組織の健康に悪影響を及ぼす可能性があるため、ミトコンドリア機能の評価は前臨床薬物安全性評価における重要なステップです。
ミトコンドリア機能を評価するための高感度で有益な方法の一つは、ミトコンドリアの代謝活性の変化をモニターするためのミトコンドリア膜電位(MMP)の測定です。ミトコンドリア膜電位は、アポトーシス中のミトコンドリア偏光解消の検出、多剤耐性細胞の検査、および様々な毒性スクリーニングのためのミトコンドリア機能評価にとって重要なツールです *1-2。MITO-ID®膜電位色素は、ミトコンドリア膜電位の状態に応じて蛍光の変化を示します。特異性は、MMPに関係なく細胞質内では緑色蛍光(FITC、530 nM)単量体として存在し、健康で活性化されたミトコンドリア内では凝集して橙色蛍光(TRITC、570 nm)を発します。MMPが破壊されると、MITO-ID色素は偏光解消されたミトコンドリアから出ていき、その結果、オレンジ蛍光凝集体はほとんど生成されず、色素単量体が細胞質に蓄積します。
化合物処理に対するミトコンドリア膜電位の変化を評価するため、MITO-ID色素を用いた2種類のミトコンドリア毒性アッセイを行いました。アッセイは、浮遊がん細胞株SJKと接着がん細胞株U2OSで実施し、複数の細胞種におけるMMP評価へのMITO-ID色素の有用性と、ImageXpress Pico®自動細胞イメージングシステムのロバスト性イメージングおよび解析機能を実証しました。
材料
- SJK細胞(ATCC)。
- U2OS細胞 (ATCC)
- MITO-IDミトコンドリア膜電位検出キット (Enzo Life Sciences)
- Hoechst 33342(Enzo Life Sciences)
- 96ウェル、透明懸濁培養マイクロプレート(Greiner Bio-One)
- 96ウェル黒色壁、μClear® マイクロプレート (Greiner Bio-One)
- ImageXpress Pico 自動細胞イメージングシステムと CellReporterXpress 画像取得および解析ソフトウェア
方法
浮遊細胞および接着細胞におけるミトコンドリア毒性の測定
浮遊細胞
SJK細胞を96ウェル浮遊細胞プレートに1ウェル当たり10,000個プレーティングしました。この細胞を、2.5 nMから50 μMまでのCCCPの1:3希釈液で30分間処理。化合物処理はトリプリケートで行いました。処理後、細胞をスピンダウンし、上清を除去し、細胞を再懸濁し、1X Assay Bufferで洗浄しました。細胞をもう一度遠心し、MITO-IDおよびHoechst 33342染色液を添加する前に上清を除去。Hoechstは1Xアッセイバッファー中1μL/mLで調製し、MITO-ID膜電位検出試薬は10μL/mLで調製しました。
細胞を染色液とともに暗所、室温で15分間インキュベートした後、直ちにImageXpress Picoシステムで40倍の倍率でイメージング。DAPI、FITC、TRITC蛍光チャンネルと組み合わせて、1ウェルあたり42部位を透過光で取得しました。懸濁液中のすべての細胞に焦点が合っていることを確認するため、ウェル内の異なる深さで画像を収集。これは、Z-stackと呼ばれる画像のスタックを取得することで達成され、画像のスタックはその場で単一の2Dプロジェクション画像に合成されました。Z-stack画像取得は、5平面の小さなスタックと2μmのフォーカスステップサイズで行われました。Z--stacks画像からベストフォーカス2Dプロジェクション画像を生成し、解析に利用しました。
接着細胞
U20S細胞を、黒壁透明底96ウェルマイクロプレートに1ウェル当たり8,000個播種。プレートは図2. CCCP処理によるSJK細胞のミトコンドリア膜電位変化の評価。SJK細胞はMITO-ID膜電位色素で染色しました。A,C)はMMPに関係なく細胞質で緑色に蛍光し、インタクトなMMPを持つ偏光ミトコンドリアではオレンジ色の凝集塊を形成します。B,D) CellReporterXpressソフトウェアの3-channel Multi-Wavelength Cell Scoring Application Moduleを用いて細胞を解析。細胞はHoechst 33342核染色に基づいてセグメンテーションされ、FITC陽性(赤色セグメンテーションマスク)、TRITC陽性(青色セグメンテーションマスク)、FITCとTRITCの両方陽性(ピンク色セグメンテーションマスク)、FITCとTRITCの両方陰性(灰色セグメンテーションマスク)とスコア化されました。TRITCのみおよびFITC+TRITCで陽性となった細胞は、活性ミトコンドリアを持つ細胞としてカウントしました。E)TRITCシグナル陽性細胞の割合、F)平均TRITC細胞質強度、およびG)平均FITC細胞質強度を含むマルチパラメトリックリードアウトが解析から作成。複製を平均し、それぞれ0.639μM、0.265μM、0.05μMのEC50値を示しました。50μMのCCCPと100μMのアンチマイシンAから開始し、1:3希釈でCCCPまたはアンチマイシンAで細胞を処理しました。処理1時間後、ウェルから化合物溶液を除去し、細胞を1X Assay Bufferで1回洗浄。MITO-ID染色溶液を、製造業者のプロトコールに従って1Xアッセイバッファー中で10μL/mL調製し、Hoechst 33342を1μL/mL添加しました。プレー トを染色液とともに室温で30分間インキュベートし、HBSS(2X)で洗浄。画像はImageXpress Picoシステムで対物レンズ20Xを用い、on-the-fly stitchingプロトコルでウェルあたり6部位をイメージングしました。DAPI、FITC、TRITCの蛍光チャンネルをそれぞれ10ms、200ms、200msの露光時間で使用しました。
結果
SJK細胞のミトコンドリア膜電位に対するCCCPの表現型効果の定量化
マウス骨髄腫Bリンパ球細胞株であるSJK細胞を、強力な酸化的リン酸化阻害剤であるCCCP(プロトンイオノフォア)で処理し、処理後にMITO-ID膜電位検出キットとHoechst 33342核色素で染色。MITO-ID色素の蛍光発光の違いは、自動化されたイメージングと解析によって可視化され、定量化されました。通電した細胞では、色素は細胞質では緑色(FITC)の蛍光単量体として存在し、一方、MMPがインタクトな活性ミトコンドリアではオレンジ色(TRITC)に蛍光する凝集体を形成しました(図1および2)。ミトコンドリア膜電位の解析は、CellReporterXpress® 画像取得・解析ソフトウェアの3-channel Multi-Wavelength Cell Scoring Application Moduleを用いて行いました。細胞は核染色に基づいてカウントされ、FITCシグナル、TRITCシグナル、または両方の蛍光シグナルについて陽性または陰性と判定されました。FITCとTRITCの両方の蛍光分子を発現し、TRITC凝集体のみを発現するSJK細胞は、インタクトなミトコンドリア膜電位を陽性としてカウント(図2A-E)。蛍光マーカーの一方、両方、または両方が陽性である細胞数およびパーセント、細胞および核の面積測定、ならびに2つの蛍光マーカー(FITCおよびTRITC)の強度測定を含むマルチパラメトリック測定値が、解析から作成されました。
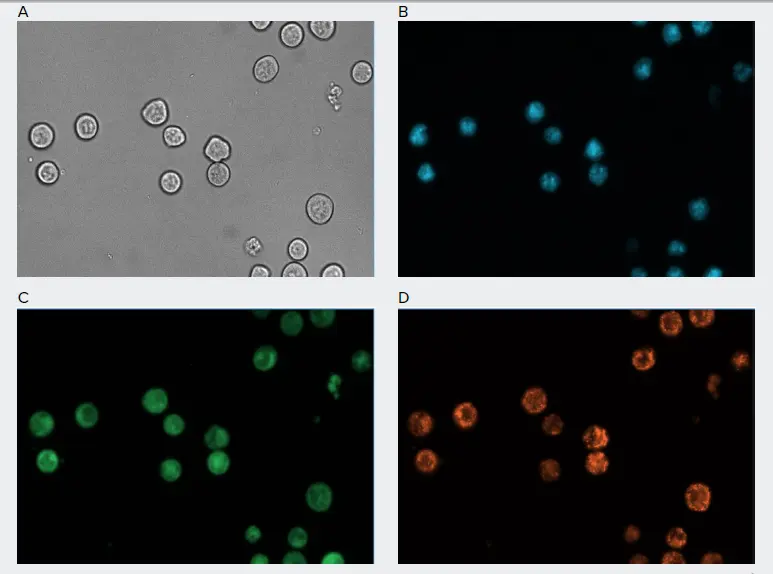
図1. ImageXpress Picoで撮影した未処理のSJK細胞の代表的な40倍画像。画像はZ-stackで異なる平面で取得し、CellReporterXpressソフトウェアでZ-stack画像を1つの2Dプロジェクション画像に畳み込みました。A)透過光チャンネルでは最良の平面2D投影像が生成され、蛍光チャンネルでは最良の焦点2D投影像が利用されました: B) DAPIチャンネル、Hoechst 33342で染色した核、C) FITCチャンネル、細胞質で緑色蛍光を発するMitoID、D) TRITCチャンネル、活性ミトコンドリアでオレンジ色蛍光を発するMitoID。
CCCPの濃度が高くなるにつれて、偏光ミトコンドリア内のオレンジ色のTRITC凝集体に対して陽性となる細胞の割合が減少することからわかるように、MMPに対する顕著な用量依存的効果が認められました(図2E)。高濃度のCCCPにおける全体的なTRITCシグナル強度の低下は、細胞質の緑色強度の増加と相まって、ミトコンドリア機能の喪失も示していました(図2F)。最高濃度の3種類では、緑色のFITCシグナルが細胞内で減少し始め、これらの濃度のCCCPの毒性作用が示されました。
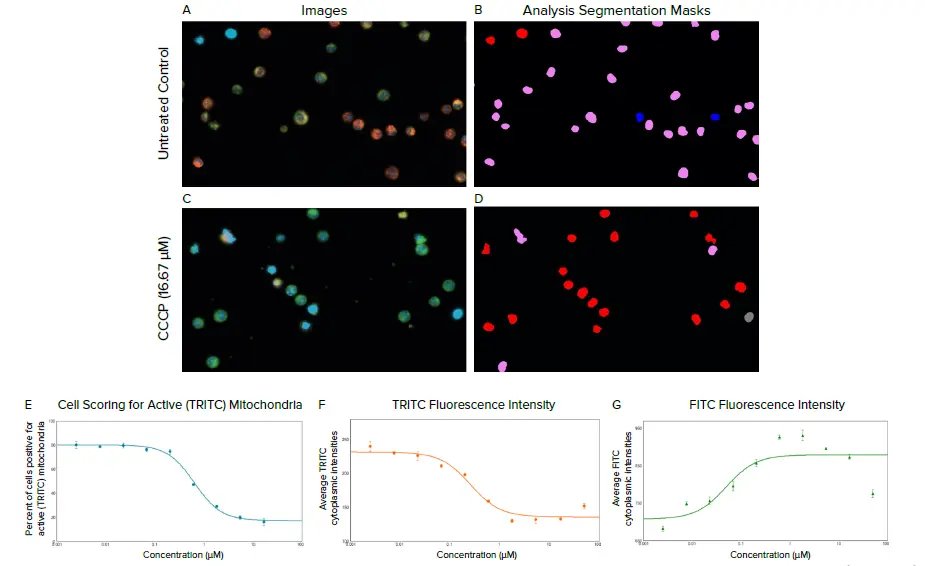
図2. CCCP処理に対するSJK細胞のミトコンドリア膜電位変化の評価。SJK細胞をMITO-ID膜電位色素で染色しました。A,C)はMMPに関係なく細胞質で緑色に蛍光し、インタクトなMMPを持つ偏光ミトコンドリアではオレンジ色の凝集塊を形成します。B,D) CellReporterXpressソフトウェアの3-channel Multi-Wavelength Cell Scoring Application Moduleを用いて細胞を解析。細胞はHoechst 33342核染色に基づいてセグメンテーションされ、FITC陽性(赤色セグメンテーションマスク)、TRITC陽性(青色セグメンテーションマスク)、FITCとTRITCの両方陽性(ピンク色セグメンテーションマスク)、FITCとTRITCの両方陰性(灰色セグメンテーションマスク)とスコア化されました。TRITCのみおよびFITC+TRITCで陽性となった細胞は、活性ミトコンドリアを持つ細胞としてカウント。E)TRITCシグナル陽性細胞の割合、F)平均TRITC細胞質強度、およびG)平均FITC細胞質強度を含むマルチパラメトリックリードアウトが解析から作成された。レプリカを平均し、それぞれ0.639μM、0.265μM、0.05μMのEC50値を示しました。
U2OS細胞におけるミトコンドリア膜電位のマルチパラメトリック解析
酸化的リン酸化の既知の阻害剤であるCCCPとアンチマイシンA(ミトコンドリア呼吸鎖複合体III阻害剤)で処理した接着U2OS細胞は、ミトコンドリア膜電位に対して顕著な用量依存的効果を示しました。これはCellReporterXpressソフトウェアのMitochondrial Analysis Moduleによって評価され、核染色に基づく総細胞数と、インタクトなMMPを持つ活性ミトコンドリアを示すオレンジ色のTRITC蛍光凝集体の数を定量するために利用(図3)。ミトコンドリア膜電位の喪失は、両化合物の濃度上昇に伴う凝集体のTRITCシグナル強度の低下に加え、細胞あたりの平均TRITC凝集体数の減少によって示されました(図4)。
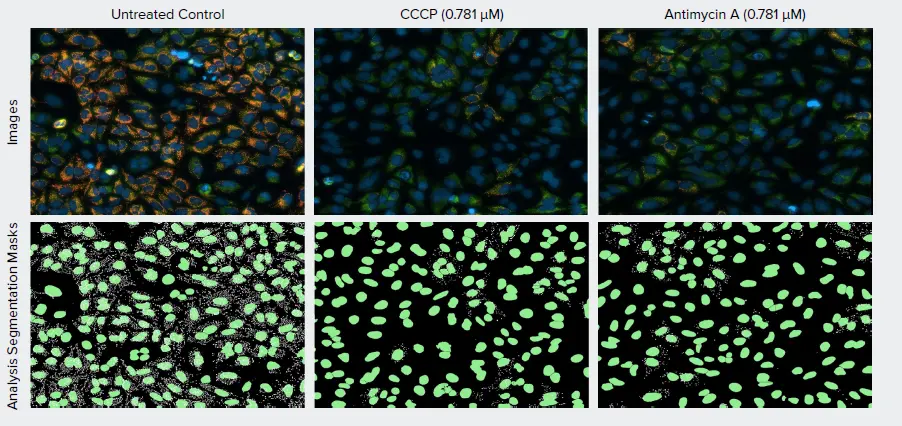
図3. U2OS細胞のミトコンドリア膜電位に対する酸化的リン酸化阻害剤の効果。細胞をCCCPまたはアンチマイシンAの希釈液で処理し、MITO-ID膜電位色素とヘキスト33342で染色しました。(上パネル)緑色蛍光細胞質色素はFITCチャンネルで、オレンジ色の凝集体はTRITCチャンネルで、青色の核はDAPIチャンネルでイメージング。(下パネル)CellReporterXpressソフトウェアのMitochondria Analysis Moduleによって解析セグメンテーションマスクが生成され、核のマスクは緑色で、TRITC蛍光凝集体のマスクは白色で表示されました。
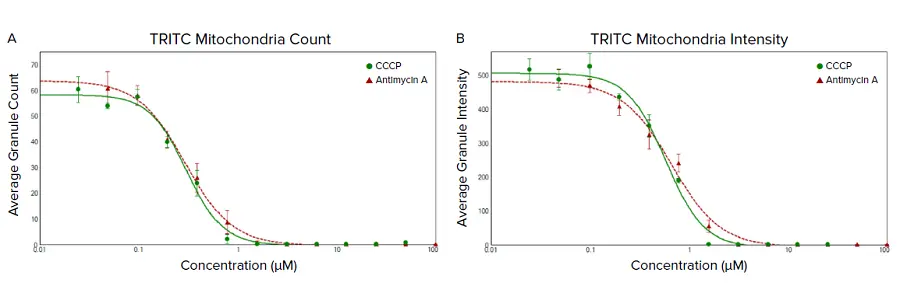
図4. 化合物処理に反応したU2OS細胞のインタクトなミトコンドリアにおけるオレンジ色のTRITC蛍光凝集体蓄積の解析。CellReporterXpressソフトウェアのMitochondrial Analysis Moduleにより、Hoechst 33342核染色に基づいて細胞を定量化し、細胞あたりのTRITC凝集体の数をカウントしました。(A)平均顆粒数と(B)凝集体の平均TRITC強度をここに表示。4パラメータロジスティックカーブフィットを適用し、平均TRITC凝集体数のEC50値は0.297μM(アンチマイシンA)および0.303μM(CCCP)、EC50値は0.656μM(アンチマイシンA)および0.574μM(CCCP)でした。
結論
自動イメージングによるミトコンドリア膜電位変化の可視化と解析に、高感度カチオン蛍光色素(MITO-ID)を効果的に使用できることを実証しました。ミトコンドリア膜電位の変化は、色素からのエミッションスペクトルの変化とマルチパラメトリックリードアウトの生成により可視化。まとめると、ImageXpress PicoシステムとMITO-ID膜電位検出キットの組み合わせは、浮遊がん細胞株と接着細胞株の両方におけるミトコンドリア膜電位の変化をモニターするための最も重要なツールであることが証明されました。これらのデータはまた、化学物質/環境毒性スクリーニングと同様に、前臨床薬物安全性評価におけるミトコンドリア機能のモニタリングにおけるこのミトコンドリア膜電位アッセイの有用性を強調しています。
参考文献
- Meyer, J. N., Hartman, J. H., & Mello, D. F. (2018). Mitochondrial Toxicity. Toxicological sciences : an official journal of the Society of Toxicology, 162(1), 15–23.https://doi.org/10.1093/toxsci/kfy008
- Srinivasan, S., Guha, M., Kashina, A., & Avadhani, N. G. (2017). Mitochondrial dysfunction and mitochondrial dynamics-The cancer connection. Biochimica et biophysica acta. Bioenergetics, 1858(8), 602–614.https://doi.org/10.1016/j.bbabio.2017.01.004
- Zorova, L. D., Popkov, V. A., Plotnikov, E. Y., Silachev, D. N., Pevzner, I. B., Jankauskas, S. S., Babenko, V. A., Zorov, S. D., Balakireva, A. V., Juhaszova, M., Sollott, S. J., & Zorov, D. B. (2018). Mitochondrial membrane potential. Analytical biochemistry, 552, 50–59.https://doi.org/10.1016/j.ab.2017.07.009.
PDF版(英語)