Application Note ライブセルイメージングを用いて
アポトーシスの各段階を経時的に解析
- 完全な環境制御下でライブセルのタイムラプスイメージングを実施
- 表現型の変化をリアルタイムでモニタリング
- 1つの解析モジュールで複数の表現型を解析可能
- 動態データレポートを自動生成
PDF版(英語)
Matthew Hammer|アプリケーションサイエンティスト|モレキュラーデバイス
はじめに
アポトーシスの研究は、創薬および医薬品開発において極めて重要な分野です。さらに、アポトーシスと酸化ストレスなどの他の因子との関係を研究することは、アポトーシスの制御異常に関連する特定の疾患を理解するうえで不可欠です。早期の細胞死やアポトーシスは、アルツハイマー病、パーキンソン病、さまざまな自己免疫疾患と関連しています *1,*2,*3。一方で、がんのような疾患は、アポトーシス経路の破綻を引き起こす変異によって、制御不能な細胞増殖が生じることで定義されます。
細胞ベースアッセイは、薬剤の細胞毒性効果を明らかにし、その作用機序を研究するための効率的なモデルです。さらに、薬剤誘導性の細胞死のメカニズムを特定し、アポトーシスをモニタリングすることで、薬剤の改良や意図しない毒性の回避が可能になります。この点において、タイムラプスライブセルアッセイは、エンドポイントアッセイと比較して明確な利点を提供します。化合物処理に対する表現型の変化をリアルタイムでモニタリングできるほか、一過性の現象の評価も可能です。また、エンドポイントアッセイの測定タイミングや化合物の適切な濃度範囲を明らかにすることで、アッセイの最適化にも役立ちます。
本研究では、抗がん化合物のHeLa細胞に対する細胞毒性効果を調べるため、2種類のアポトーシスアッセイを実施しました。長時間のタイムラプスイメージングは、ImageXpress® Pico 自動細胞イメージングシステムを用いて行いました。ライブセル環境は、ImageXpress Picoシステムに完全統合された環境制御コンポーネントによって維持されており、CellReporterXpress™ 画像取得・解析ソフトウェア内から、CO₂、O₂、温度、湿度の制御が可能です。
材料
- HeLa細胞
- HeLa培地(MEM、10% FBS、1% Pen/Strep)
- 生細胞イメージング培地(Fluorobrite DMEM、5% FBS、1% L-グルタミン、1% Pen/Strep)
- 96ウェルマイクロプレート(Greiner)
- 384ウェルマイクロプレート (Corning Falcon)
- スタウロスポリン(Millipore Sigma)
- パクリタキセル(Millipore Sigma)
- EarlyTox Caspase-3/7 NucView 488アッセイキット、エクスプローラー(モレキュラーデバイス、cat. #R8350)
- エチジウムホモダイマーIII(モレキュラーデバイス、EarlyTox Live/Deadアッセイキット、エクスプローラー、cat. #R8340)
- Hoechst 33342(インビトロジェン)
- CellROX ™ Deep Red 試薬(サーモフィッシャーサイエンティフィック)
- ImageXpress Pico 自動細胞イメージングシステムおよび CellReporterXpress 画像取得・解析ソフトウェア(モレキュラーデバイス)
方法
細胞の健康とアポトーシスアッセイ
HeLa細胞を384ウェルマイクロプレートに1ウェルあたり5,000細胞の密度で播種し、37°C、5% CO₂環境下で一晩インキュベートしました。その後、HeLa培地中に3 µMのHoechst 33342を加え、45分間染色しました。インキュベーション後、Hoechst溶液を除去し、以下を含む2倍濃度の染色液と化合物を添加しました:NucView 488 Caspase 3/7(最終濃度5 µM)、Ethidium Homodimer III(EthD-III、最終濃度1 µM)。この染色液および化合物の希釈液は、フェノールレッドを含まないライブセルイメージング用培地で調製しました。化合物処理は3反復で行い、スタウロスポリンは10 µM、エトポシドは100 µMから1:2の希釈系列で開始しました。
酸化ストレスおよびアポトーシスアッセイ
HeLa細胞を96ウェルマイクロプレートに1ウェルあたり8,000細胞の密度で播種し、37°C、5% CO₂環境下で一晩インキュベートしました。その後、各ウェルから培地を除去し、3 µMのHoechst 33342および5 µMのCellROX Deep Redを含む染色液を添加しました。40分間のインキュベーション後、染色液を除去し、温めたDPBSで2回洗浄しました。次に、NucView 488 Caspase 3/7(最終濃度5 µM)の2倍濃度溶液と、スタウロスポリンの1:2希釈系列(開始濃度10 µM)を各ウェルに添加しました。NucView 488溶液および化合物の希釈液は、ライブセルイメージング用培地で調製しました。化合物処理は4反復で実施しました。
長時間ライブセルイメージング
長時間ライブセルイメージングは、ImageXpress Pico 環境制御システムを用いて実施しました。プレートは装置内ステージに設置可能な環境制御カセットに配置され、外光から保護された状態で、所望の環境制御設定(5% CO₂、85%湿度、20% O₂、37°C)を完全に維持することができました。細胞の健康とアポトーシスアッセイでは、2時間ごとに画像を取得する14時間のタイムラプス撮影を行いました。酸化ストレスアッセイでは、1時間ごとに画像を取得する6時間の撮影を行いました。両アッセイの取得設定は表1に記載されています。取得中は環境制御センサーの読み取り値を記録し、環境制御設定のモニタリングおよび品質管理(QC)を実施しました。
| 対物レンズ | (FOV) | サイト数 | 蛍光チャンネル(露光時間単位ms) |
|---|---|---|---|
| セルヘルスアポトーシスアッセイ | 10X (1.39 mm x 1.39 mm) | 1 (ウェルの17.63%) |
DAPI (10) FITC (200) Texas Red (100) |
| 酸化ストレスアポトーシスアッセイ | 20X (0.69 mm x 0.69 mm) | 4 (ウェルの5.1%) |
DAPI (10) FITC (200) Cy5 (500) |
表1. セルヘルスおよび酸化ストレスアポトーシスアッセイにおける取得設定 10X倍率での単一撮影領域は、384ウェルマイクロプレートの1ウェルあたり17.63%をカバーしました。20X倍率での4領域撮影では、96ウェルマイクロプレートの1ウェルあたり5.1%をカバーしました。20Xの4領域取得は、画像の継ぎ目が目立たないように、オンザフライで画像を自動結合するプロトコールで実施されました。
画像解析
多波長解析により、細胞死の各段階における細胞の健康状態を評価可能
図1に示すように、CellReporterXpressソフトウェアの3チャンネル細胞スコアリング解析モジュールを使用して、3種類の蛍光色素の分布を測定し、化合物処理後の細胞表現型の変化を定量化しました。アポトーシスの初期段階では、核の凝縮とカスパーゼ活性化が重要なステップです。核凝縮は、Hoechst核染色の蛍光強度の増加と核面積の減少によって確認されました(図2A)。caspase 3/7染色のみ陽性の細胞は、初期アポトーシスとしてスコアリングされました(図1)。スタウロスポリンの最高濃度では6時間後、エトポシドの最高濃度では14時間後に、初期アポトーシス細胞数が最大となりました(図2B)。後期アポトーシスは、膜透過性の増加と、caspaseおよびEthidium Homodimer IIIの両方に陽性の細胞によって判定されました。ネクローシス細胞は、Ethidium Homodimer IIIのみ陽性の細胞として識別されました。14時間時点でカーブフィッティングを行い、用いた化合物の用量反応曲線およびEC₅₀値を算出しました(図3)。その結果、スタウロスポリンでは0.039~10 µM、エトポシドでは7.5~100 µMの濃度範囲で、用量依存的な細胞生存率の低下が認められました。この時点では、スタウロスポリンの最高濃度で初期アポトーシス細胞の割合が減少し、ネクローシスおよび後期アポトーシス細胞の割合が増加しました。一方、エトポシドでは7.5~100 µMの濃度で、細胞の多くが初期アポトーシス状態にあり、後期アポトーシスやネクローシス細胞の割合を増加させるには、処理時間の延長または濃度の増加が必要である可能性が示唆されました。
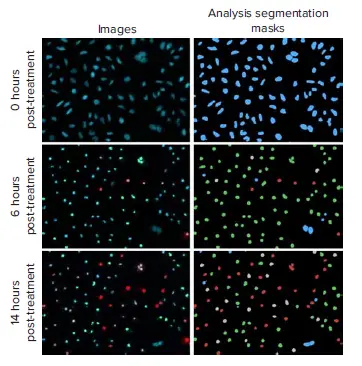
図1. スタウロスポリン(10 µM)処理後0、6、14時間におけるHeLa細胞の代表的な画像と解析 セグメンテーションマスク CellReporterXpressソフトウェアの3チャンネル細胞スコアリング解析モジュールを用いて、アポトーシス表現型の明確な変化を解析しました。生存細胞(青マスク)、Caspase 陽性細胞(緑マスク)、CaspaseおよびEthD-III陽性細胞(灰色マスク)、EthD-IIIのみ陽性細胞(赤マスク)として分類されました。
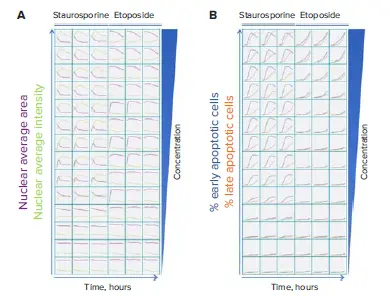
図2. スタウロスポリンおよびエトポシドの各濃度処理後14時間にわたり、アポトーシスの段階をリアルタイムでモニタリング 画像は2時間ごとに取得されました。A. Hoechst 33342核染色を用いて核凝縮を測定。B. Hoechst 33342染色細胞を対象に、Caspase 3/7およびEthidium Homodimer III染色により細胞死の段階を評価。
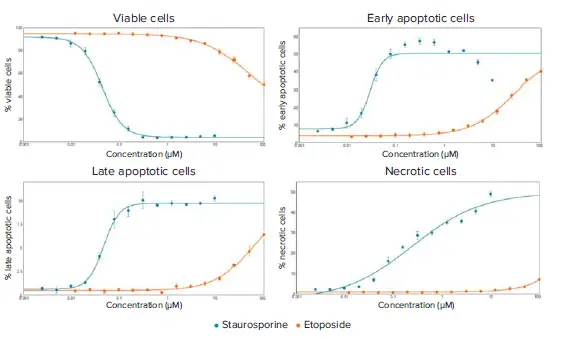
図3. スタウロスポリンおよびエトポシド処理細胞の14時間時点での用量反応曲線 4つの曲線に対してEC₅₀値を算出:生存細胞(スタウロスポリン:0.044 µM、エトポシド:48.61 µM)、初期アポトーシス細胞(スタウロスポリン:0.029 µM、エトポシド:25.84 µM)、後期アポトーシス細胞(スタウロスポリン:0.047 µM、エトポシド:61.81 µM)、ネクローシス細胞(スタウロスポリン:0.238 µM、エトポシド:EC₅₀未到達)
多波長解析により、酸化ストレスとアポトーシスを同時に評価可能
タイムラプス取得による応答の記録は、最適な実験エンドポイントや、望ましい効果を誘導する化合物の理想的な濃度を決定するうえで有用です。また、同一ウェル内で複数の生物学的活性(その中には一過性の現象も含まれます)を測定することが可能です。図4に示すように、多波長細胞スコアリング解析を用いて、3種類の異なる細胞集団を識別しました。酸化ストレスおよびアポトーシスの最大応答は、スタウロスポリンの濃度に依存していました。高濃度の3条件では、ROSレベルが早期にピークに達し、その後caspase 3/7の活性化が3~4時間の間に増加しました。スタウロスポリンの低濃度条件では、ROS陽性細胞およびCellROXの蛍光強度が徐々に増加しましたが、アポトーシスの顕著な誘導は認められませんでした(図5および図6)。このアッセイを単一のエンドポイントで実施する場合、スタウロスポリン処理後6時間でのイメージングが推奨されます。
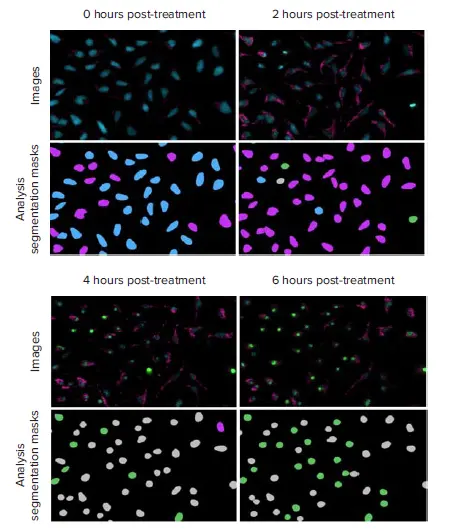
図4. 酸化ストレスの蓄積およびカスパーゼ活性化を経時的に示すHeLa細胞の代表的な20Xイメージング画像と解析セグメンテーションマスク これらの画像は、5 µMのスタウロスポリンで処理された細胞から取得されました。画像:核(Hoechst 33342、青)、caspase 3/7(NucView 488、緑)、ROS(CellROX Deep Red、ピンク)。3チャンネル細胞スコアリング解析を実施し、各時間点における健康な細胞(青)、酸化ストレスのみ陽性の細胞(ピンク)、caspase 3/7のみ陽性の細胞(緑)、酸化ストレスおよびcaspase 3/7の両方に陽性の細胞(灰色)の数と割合を測定しました。
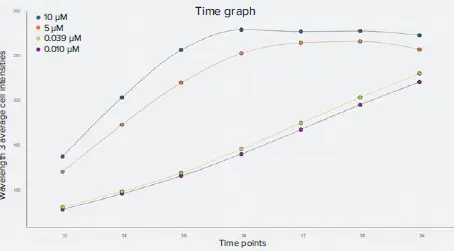
図5. 波長3(CellROX Deep Red)の平均細胞蛍光強度の動態グラフ スタウロスポリンの高濃度条件(10 µMおよび5 µM)では、CellROX Deep Red染色の蛍光強度が3~4時間付近でピークに達し、その後プラトーに移行しました。スタウロスポリンの低濃度条件では、CellROX Deep Red染色の蛍光強度が時間経過とともに徐々に増加しました。
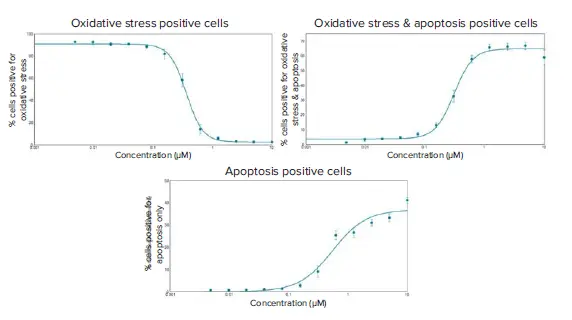
図6. スタウロスポリン処理後6時間におけるHeLa細胞の酸化ストレスおよびアポトーシス誘導の用量反応曲線 3種類の表現型指標に対してEC₅₀値を算出しました:酸化ストレスのみ陽性の細胞:0.361 µM、酸化ストレスおよびアポトーシス両方に陽性の細胞:0.314 µM、アポトーシスのみ陽性の細胞:0.547 µM
結論
これらのアッセイは、完全なライブセル環境下でタイムラプスイメージングを実施することにより、複数のセルヘルスマーカーをリアルタイムで同時にモニタリングできる利点を示しています。ImageXpress Pico 自動細胞イメージングシステムは、環境制御機能を備えており、HeLa細胞が複数の細胞死段階を経る様子を時間的に観察することが可能です。さらに、これらの実験は、アポトーシス経路のさまざまな段階にある細胞を測定するための3チャンネル細胞スコアリング解析モジュールの有用性を示しており、抗がん化合物の細胞毒性効果に関する貴重な知見を提供します。
参考文献
- J.M. Brown, L.D. Attardi (2005). The role of apoptosis in cancer development and treatment response. Nat Rev Cancer 5(3):231-7.
- D.W. Dickson (2004). Apoptotic mechanisms in Alzheimer neurofibrillary degeneration: cause or effect? J Clin Invest 114(1):121-30.
- W.G. Tatton, R. Chalmers-Redman, D. Brown, N. Tatton (2003). Apoptosis in Parkinson’s disease: signals for neuronal degradation. Ann Neurol 53(suppl 3): S61-70.
PDF版(英語)