Application Note ヒトiPSC由来心筋細胞を用いた
化合物誘導性不整脈作用のマルチパラメトリック評価
- CiPA心毒性化合物をiPSC心筋細胞フェノタイプアッセイで特性評価
- HS EMCCDカメラによる最大100 images/secのイメージングでカルシウムピークの分解能を向上
- 新しいScreenWorks Peak Pro 2ソフトウェアによりピーク特性評価を強化
PDF版(英語)
Oksana Sirenko | Senior Research Scientist | モレキュラーデバイス
Krithika Sridhar | Manager, Software Engineering | モレキュラーデバイス
Carole Crittenden | Applications Scientist | モレキュラーデバイス
はじめに
化合物スクリーニングおよび毒性評価のための生物学的に関連性の高い予測的な細胞ベースアッセイの開発は、創薬における大きな課題です。本研究では、ヒト人工多能性幹細胞(iPSC)由来心筋細胞を用いたハイスループットスクリーニングに対応可能な心毒性アッセイの確立を目的としました。ヒトiPSC由来心筋細胞をin vitroの不整脈モデルとして活用する可能性を評価するため、CiPAイニシアチブが推奨する化合物リストから、torsades de pointes(TdP)リスクが低・中・高に分類される28種類の薬剤について、濃度依存性および応答を評価しました *1。
各種化合物が心筋細胞の自発的な収縮率および収縮パターンに与える影響は、カルシウム感受性色素を用いた高速キネティック蛍光測定による細胞内Ca²⁺オシレーションの変化を通じてモニタリングされました。Ca²⁺オシレーションパターンのマルチパラメトリックな特性評価には、高度なイメージ解析手法を導入しました。さらに、ハイコンテントイメージング法を用いて、化合物が心筋細胞の生存率、細胞骨格の再構築、およびミトコンドリア膜電位に与える影響を評価しました *2。このフェノタイプアッセイでは、拍動頻度、振幅、ピーク幅、立ち上がり時間および減衰時間、細胞生存率、形態的特徴などのパラメータを評価することが可能です。これらの結果は、iPSC心筋細胞が薬剤誘導性不整脈作用をin vitroで検出するために有用であることを示しています。
FLIPR Pentaシステムによるカルシウムオシレーションの評価
iPSC由来心筋細胞は、自発的かつ同期したカルシウムオシレーションを生成します。FLIPR® Penta ハイスループットセルベーススクリーニングシステムを用いた高速蛍光イメージングにより、モレキュラーデバイスのEarlyTox™ 心毒性キットを使用して、心筋細胞内のCa²⁺濃度変化を通じてオシレーションパターンと頻度を測定しました。既知の心毒性化合物28種類に加え、ベンチマーク化合物およびネガティブコントロールもアッセイにて評価しました。
使用装置
FLIPR Pentaシステムは、新しい高速カメラとScreenWorks® Peak Pro 2ソフトウェアモジュールを搭載しています。
この装置には、iPSC由来心筋細胞および神経細胞に関連する一次および二次ピーク、複雑なオシレーションパターンの解析・特性評価を可能にするScreenWorks Peak Pro 2ピーク解析ソフトウェアモジュールが搭載されています。ScreenWorksソフトウェアで利用可能なパラメータの一部は図2に示されています。
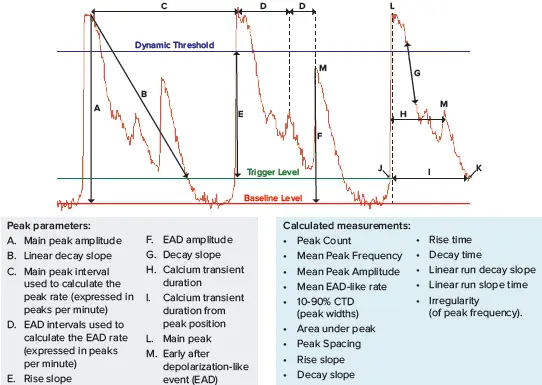
図2. 新しいScreenWorks Peak Pro 2ソフトウェアは、観察されたフェノタイプ変化に対して20以上の記述子を用いたピーク解析のための追加ツールを搭載しています。細胞内Ca²⁺オシレーションは、EarlyTox 心毒性キットを用いて評価されました。
方法
iPSC由来心筋細胞
モレキュラーデバイスのCellular Dynamics International(CDI)社から提供されるiCell® Cardiomyocytes2としての凍結保存済みヒトiPSC由来心筋細胞を使用しました。細胞は解凍後、96ウェルフォーマットでは20,000 cells/well、384ウェルフォーマット(Corning)では10,000 cells/wellで播種し、メンテナンス培地で7日間培養しました。実験開始前に、培養中の強い同期収縮の存在を目視で確認しました。図1には、ImageXpress® Micro Confocal ハイコンテントイメージングシステム上でのiPSC心筋細胞におけるカルシウムフラックスによる蛍光変化の例が示されています。

図1. ImageXpress® Micro Confocalシステムを用いて測定されたカルシウムオシレーション。カルシウム感受性色素をロードしたiPSC心筋細胞の0.2秒間隔のタイムラプスイメージ。
心筋細胞は、図に示すように15分、30分、60分、90分、または24時間、化合物に曝露されました。
カルシウムオシレーションアッセイ
細胞内Ca²⁺オシレーションは、モレキュラーデバイスのEarlyTox 心毒性キットに含まれるEarlyTox カルシウム色素(製品番号:R8210)を用いて評価しました。通常のプロトコールに従い、測定の2時間前に色素を細胞にロードしました。細胞は様々な時間で化合物に曝露され、イメージングは0.03秒間隔で1〜2分間実施されました。ピークの特性評価にはScreenWorks Peak Pro 2ソフトウェアを使用しました。評価されたパラメータの例は図2に示されています。
細胞染色
フェノタイプ変化を評価するために、以下の3種類の色素を混合してライブ染色を行いました:生存率評価用Calcein AM(1 µM)、ミトコンドリア膜電位評価用MitoTracker Orange(0.2 µM)、核染色用Hoechst色素(2 µM)(すべてLife Technologies社製)*2。
結果
キネティックパターンの記録と解析
モレキュラーデバイスのCellular Dynamics International(富士フィルム)から提供されたiCell Cardiomyocytes2をEarlyTox 心毒性キットで処理し、上記の条件で化合物に曝露しました。細胞生存率は24時間後に評価されました。自発的なカルシウムオシレーションは、30〜50フレーム/秒で記録され、複雑なオシレーションパターンの最適な分解能を確保しました。ScreenWorks Peak Pro 2ソフトウェアの高度な解析機能により、Ca²⁺フラックス振動パターンのマルチパラメトリックな特性評価が可能となりました。このフェノタイプアッセイでは、振動頻度、振幅、ピーク幅、立ち上がり時間、減衰時間、不規則性などの出力を評価できます。さらに、EAD様(早期後脱分極様)パターン、ピークの延長、不規則性の出現も評価されました。
化合物のフェノタイプ効果
iPSC由来心筋細胞におけるカルシウムオシレーションの測定は、毒性評価において有望な手法です。本研究では、臨床データに基づきtorsades de pointes(TdP)リスクが高・中・低に分類された28種類のCiPA化合物の評価に焦点を当てました。TdPは、感受性のある患者においてこれらの薬剤が引き起こす可能性のある心拍の不整であり、致死的リスクを高めることがあります。一部の薬剤によって引き起こされた代表的なカルシウムオシレーションパターンの例は図3に示されています。ピーク数、振幅、ピーク幅(90%ピーク高さでの増加:CTD90)、ピーク高さの20%から80%までの減衰時間に関する濃度依存性およびEC₅₀値は図4に示されています。
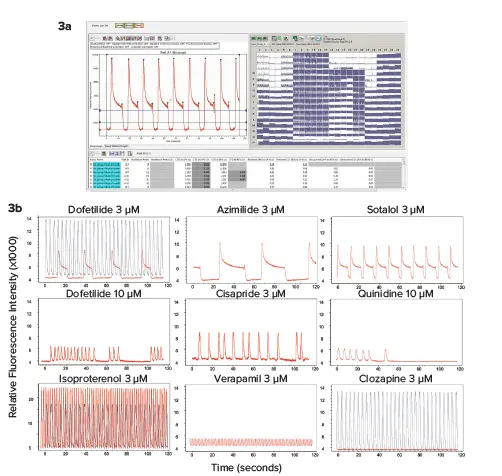
図3. 新しい高速EMCCDカメラ(FLIPR Pentaシステム)を用いて、カルシウム感受性色素により細胞内Ca²⁺振動の頻度とパターンに対する各種化合物の影響を評価しました。3a)FLIPR Pentaシステムを用いて、384ウェルプレート全体のハイスループット記録と解析を同時に実施しました。3b)コントロールおよび化合物処理サンプルにおけるカルシウムオシレーションの代表的なトレースを示しています。細胞は2時間色素をロードした後、30分間化合物に曝露されました。パターンには濃度依存的な変化が観察されました。オシレーショントレースはFLIPR Pentaシステムで2分間記録され、ScreenWorks Peak Pro 2ソフトウェアで特性評価されました。化合物処理群のトレースは赤、コントロール群は黒で示されています。
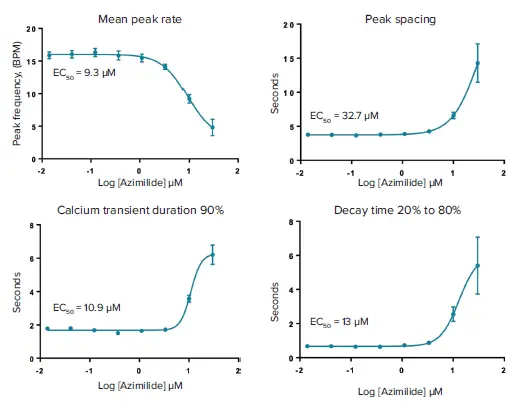
図4. 平均ピーク頻度、ピーク間隔、ピーク延長の変化に対する濃度依存性およびEC₅₀値。
心毒性作用のマルチパラメトリック評価
このアッセイは、in vitroにおける化合物の心毒性作用をハイスループットで評価する有望な手法であり、薬剤や新規化合物の優先順位付けやさらなる試験への選定に役立ちます。ScreenWorks Peak Pro 2ソフトウェアでは、波形に対して20以上の記述子を用いた解析が可能です。本研究では、オシレーション変化の記述にマルチパラメトリックなアプローチを採用しました。表1には、TdP症候群のリスクがある薬剤に対する複数のパラメトリック測定結果が示されており、感受性のある患者に投与された場合、心拍停止を引き起こす可能性があります。
| 化合物 | ドフェチリド | アジミリド | ソタロール | キニジン | シサプリド | クロザピン | イソプロテレノール | ベラパミル | DMSOコントロール |
|---|---|---|---|---|---|---|---|---|---|
| TdP risk 1 |
High | High | High | High | Int | Int | Low | Low | None |
| Cmax (μM) 1 |
0.002 | 0.07 | 15 | 3 | 0.003 | 5.2 | 0.1 | 0.1 | 効果なし |
| Peak count EC50 (μM) 2 |
0.004 | 2.1 | 13.1 | 3.36 | <0.1 | 5.2 | 0.1 | 0.2 | 効果なし |
| Amplitude EC50 (μM) 2 |
~0.3 | 15.3 | ~100 | 320 | 10 | 2.6 | 32 | 0.07 | 効果なし |
| Fold peak width increase | 0.1 | 5.9 | 25.4 | 0.1 | ~1 | 効果なし | 減少 | 減少 | 効果なし |
| EAD-like event* | 0.01 | 0.3 | 15 | 3 | 0.06 | – | – | – | – |
| Peak prolongation* | 0.01 | 0.3 | 3 | 1 | 0.06 | – | – | – | – |
| Oscillation irregularity* | 10 | – | 3 | 10 | 2 | – | – | – | – |
| Fibrillation* | 10 | – | – | – | – | – | 200 | 1 | – |
| Oscillation stop* | – | – | – | 10 | 20 | 7 | – | 3 | – |
| 24 hour cytotoxicity* | – | 30 | – | 10 | – | – | – | – | – |
表1. フェノタイプアッセイ結果 心疾患治療薬の3つのリスクレベルは、ピーク特性および細胞毒性を含む複数のパラメータによって特徴づけられます。1 TdPリスクおよびCmax 2 ScreenWorks Peak Pro 2ソフトウェアによるEC₅₀値
※ScreenWorks Peak Pro 2ソフトウェアで得られた各種出力に対して特定の変化を引き起こした最も低い濃度(μM)を示しています。変化が観察されなかった場合は「–」で示されています。
ハイコンテントイメージングによる細胞形態および生存率の評価
共焦点イメージングおよび画像解析手法を用いて、iPSC由来心筋細胞に対する化合物の形態および生存率への影響を評価しました。細胞毒性の評価には、化合物を24時間処理した後、ImageXpress Micro Confocalシステムでイメージングを行いました。画像はCell Scoringアルゴリズムを用いて解析され、全細胞数、生存細胞数(Calcein AM陽性細胞)、ミトコンドリアが健常な細胞数(MitoTracker陽性細胞)を検出しました。結果は図5に示されています。
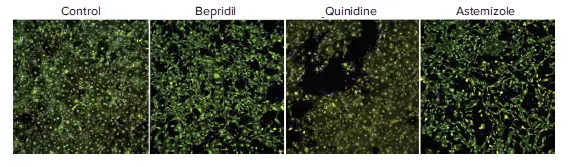
図5. 指定された化合物を10 µMで24時間処理した心筋細胞の合成画像。核染色(Hoechst 33342、青)、生存率染色(Calcein AM、緑)、ミトコンドリア膜電位色素(MitoTracker Orange CMTMRos、赤)で2時間染色(それぞれ2 µM、1 µM、0.5 µM)。DAPI、FITC、TRITCフィルターキューブおよび10X Plan Fluor対物レンズでイメージングを実施。以下の化合物では10 µM以上の濃度で24時間後に細胞毒性が観察されました:アジミリド、ベプリジル、キニジン、アステミゾール。クラリスロマイシン、テルフェナジン、タモキシフェン、バンデタニブに関する類似データは未掲載。
まとめ
- FLIPR Pentaシステムは高速カメラを搭載しており、心筋細胞におけるカルシウムオシレーションパターンの分解能を向上させます。
- 新しいScreenWorks Peak Pro 2ソフトウェアは、20以上のパターン記述子を用いた複雑なイベント解析と詳細なパターン特性評価を可能にします。
- 本研究では、iPSC由来心筋細胞を用いた化合物の影響および潜在的な心毒性の評価手法を開発し、その実現可能性を示しました。
- 心不整脈を誘発することが知られている28種類のCiPA化合物を用いて、様々なフェノタイプ応答を確認しました。代表的なデータも提示しています。
- これらのアッセイは、新規薬剤の試験や化学物質の潜在的な心毒性リスクのスクリーニングに活用できます。
参考文献
- Blinova et al., 2018, Cell Reports 24, 3582–3592, 25 September, 2018
- Sirenko et al, Toxicol Appl Pharmacol. 2017
- Kopljar et al, Stem Cell Reports 2018
PDF版(英語)