Application Note 赤ワインのフェノール化合物測定
- 従来のキュベットベースのメソッドと比較してスループットが向上
- SoftMax Proソフトウェアによる自動データ解析
- マイクロプレートウェルの吸光度を正規化するPathCheckセンサー
PDF版(英語)
はじめに
赤ワインのタンニン、鉄反応性フェノール、アントシアニン、高分子色素の測定は、ワイン産業における品質管理の重要な部分です。ワインのフェノール化合物を正確で信頼性の高い測定をすることは、発酵、マセラシオン、圧搾、ブレンド時の決断に不可欠です。Harbertsonらは2003年、包括的な赤ワインフェノールアッセイを開発しました *1。従来、このアッセイはキュベットベースのUV-vis分光光度計を用いて行われていました。個々のサンプルを別々のキュベットで読み取り、結果を記録し、データを分析するという、時間と手間のかかる作業です。Herediaらは、迅速で費用対効果の高いアッセイの必要性を認識し、このアッセイをマイクロプレートプラットフォームに適応させました。このアプローチにより、労力、時間、サンプル量に関するスループットが向上しました。このアッセイは、平均的な規模のワイナリーでフェノール化合物の抽出のため発酵をモニターする能力を広げます。ここでは、モレキュラーデバイス SpectraMax® Plus 384マイクロプレートリーダーとSoftMax® Proソフトウェアを使用して、このアッセイのデータを効率的に収集および解析する方法についてご説明します。
SpectraMax Plus 384マイクロプレートリーダーのユニークな機能の一部をご紹介します:
- 波長範囲: 190-1000 nm(1nm単位)
- デュアルモノクロメーターベースの光学系により、フィルターが不要(図1)
- 測定速度:96ウェル:9秒 384ウェル:29秒
- 温度 周囲温度より4℃高い温度から45℃まで
- キュベットポート: 標準キュベットおよび12 x 75 mm試験管に対応
- OD範囲 0-4 OD
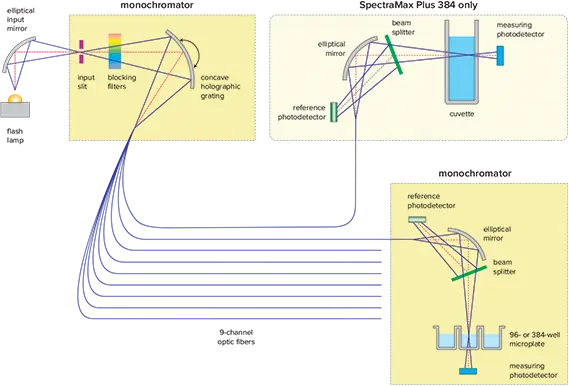
図1. SpectraMax Plus 384の光学技術
赤ワインフェノール アッセイ
Adams/Harbertsonアッセイは、分光光度法、タンパク質沈殿法、および重亜硫酸塩漂白法を使用して、赤ワインのフェノールを測定します。
PathCheck センサー
PathCheck®センサーは、マイクロプレートウェル内のサンプルの光路長を測定するモレキュラーデバイスの温度に依存しない機能です。マイクロプレートウェルの吸光度を1cmキュベットの吸光度に正規化する画期的な方法です。
ランベルト・ランベールの法則は以下の通りです。
吸光度 = E * C * L
ここで
E = 吸光度(消衰係数)
C = 濃度
L = 光路長
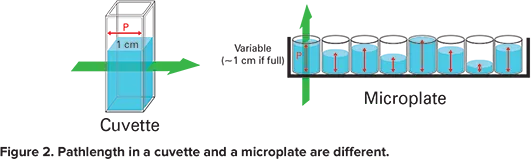
キュベットの場合、光路は水平です。したがって光路長は固定され、1cm に等しいです。しかしマイクロプレートの場合、光路は垂直です。そのため、光路長はサンプルの体積に依存します(図2)。PathCheckセンサーはこの不一致を補正します。
SoftMax Proソフトウェア
このソフトウェアは、機器の制御、データ収集、完全なデータ解析を行います。適切な機器設定と計算を含むカスタムプロトコルを事前に作成し、保存することができます。エンドユーザーは、設定済みのプロトコルを開くだけで、プロトコルのセットアップ時間をかけることなく、完全な結果と解析を得ることができます。
材料
- ワインのサンプル:ピノ・ノワール(Sonoma Coast)
- マレイン酸(フィッシャーサイエンティフィック)
- ウシ血清アルブミン (Sigma)
- トリエタノールアミン (Sigma
- 塩化第二鉄六水和物(Sigma)
- (+)-カテキン(Sigma)
- 酢酸(Sigma)
- 塩化ナトリウム (フィッシャーサイエンティフィック)
- 水酸化ナトリウム(フィッシャーサイエンティフィック)
- エタノール(Acros)
- 酒石酸カリウム (Sigma)
使用機器とアクセサリー
- SpectraMax Plus 384マイクロプレートリーダー(モレキュラーデバイス)
- UV透明96ウェルマイクロプレート (Costar)
- トランスファーペットマイクロピペット(Drummond Scientific、Drummond Digital Microdispenser)
- マイクロピペット用マイクロチップ (Eppendorf、Reloads)
- マイクロフュージチューブ用遠心分離機(Eppendorf)
- 容量1.5 mLのマイクロフュージチューブ(Eppendorf)
| 溶液名/最終溶液濃度 | 試薬および試薬量(μL、mL)または質量(g、mg) | 最終容量(mL) 脱イオン水または緩衝液 | 保存 |
|---|---|---|---|
| 緩衝液A
・200 mM 酢酸 |
・氷酢酸 (6.0 mL) ・NaCl (4.97 g) ・10% NaOH(pH4.9に調整する) |
500 mLに満たす DI |
室温 |
|
緩衝液B ・12% EtOH (v/v) |
・酒石酸カリウム (2.5 g) ・200プルーフエタノール (60 mL) ・2.0N塩酸(pH3.3に調整) |
500mLに満たす DI |
室温 |
|
緩衝液C ・5% トリエタノールアミン (v/v) |
・ドデシル硫酸ナトリウム (25 g) ・トリエタノールアミン (25 mL) ・2.0N塩酸(pH9.4に調整) |
500 mLに満たす DI |
室温 |
|
緩衝液D ・200 mM マレイン酸 |
・マレイン酸 (11.61 g) ・NaCl (4.97 g) ・10% NaOH (pH1.8に調整) |
500mLに満たす DI |
室温 |
|
塩化鉄 ・0.01 N HCl |
・塩化第二鉄六水和物 (0.27 g) ・12.1 N HCl (80 µL) |
100 mLに満たす DI H2O |
室温 |
|
漂白 ・0.36 m K2S2O5 |
・メタ重亜硫酸カリウム (0.395 g) | 5.0mLに充填
DI |
必要に応じて調製 |
|
カテキン ・1 mg/mL (+)-カテキン |
・(+)-カテキン (50 mg) ・200 プルーフエタノール (5.0 mL) |
50mLまで充填 DI |
凍結(-20) |
|
タンパク質 ・1 mg/mL BSA |
・ウシ血清アルブミン (50 mg) |
50mLに充填 緩衝液 A |
必要に応じて調製 |
表1. 包括的赤ワインフェノール測定用試薬の調製(Harbertson et al. 2003, Picciotto 2002より要約)。
方法
カテキン標準曲線
マイクロプレートにカテキン 0~300 mg/L の範囲をカバーする希釈液を二重に作製しました。プレートをシェーカーで振とうし、各ウェルに塩化第二鉄溶液38 µLを添加しました。プレートを振とうし、さらに10分間インキュベートした後、吸光マイクロプレートリーダーで510 nmの吸光度を読み取りました。ブランクとして緩衝液Cを用いました。
タンニン分析
希釈したワインサンプル500 µLを1.5 mLマイクロフュージチューブに加えました。次に、BSAを含む緩衝液A(最終濃度1 mg/mL)1 mLをチューブに加え、チューブを反転させて試薬を直ちに混合しました。13,500gで遠心し、タンニン-タンパク質複合体をペレット化しました。262μLのアリコートをマイクロプレートに移し、マイクロプレートリーダーで510nmの吸光度をブランクとして読み取りました(タンニンのバックグラウンド測定)。38μLの塩化第二鉄試薬を各ウェルに加え、マルチチャンネルピペッターで混合し、室温で10分間インキュベートしました。ブランクとして緩衝液Cを用い、510 nmで2回目の読み取りを行いました(タンニン最終測定)。各サンプル中のタンニン量を表2に記載しましたように算出し、mg/Lカテキン当量で表しました。
| Component
a |
Calculations | Factors | x Dilution factors
b |
|---|---|---|---|
| タンニン |
Abs due tannin c = [(Tannin Final)–(zero catechin)]– (Tannin Background * 0.875) |
x 2 | x 5 |
| サンプル計算 | ・Tannin Final = 0.50, Tannin Background = 0.05, zero catechin = 0.002, intercept (b) = 0.0075, slope (m) = 0.0053; ・Abs due tannin = [0.50-0.002]–(0.05*0.875) = 0.4542 ・Tannin = x = (y–b)/m then multiply by factors = [(0.4542–0.0075)/0.0053] *2*5 = 843 mg/L CE |
||
| IRP |
Abs due IRP d = [(IRP Final)–(zero catechin)]–(IRP Background * 0.875) |
n/a | x 20 |
| サンプル計算 | ・IRP Final = 0.80, IRP Background = 0.10, zero catechin = 0.002, intercept (b) = 0.0075, slope (m) = 0.0053; ・Abs due IRP = [0.80-0.002]–(0.10*0.875) = 0.7105 ・IRP = x = (y–b)/m then multiply by dilution factor = [(0.7105-0.0075)/0.0053]*20 = 2,652 mg/L CE |
||
| アントシアニン | (Measurement D-Measurement A)/factor Muliply D and A by respective dilution factors, where dilution factor for D is twice that of A | divide by 0.0102 | D x 10
A x 5 |
| サンプル計算 | ・B = 0.2200, C = 0.1200; ・Anthocyanin = [(0.4503*10)–(0/3800*5)]/0.0102 = 255 mg/L M-3-G |
||
| LPP | (Measurement B–Measurement C) * factors |
x 3 x 1.08 x 4/3 |
x 5 |
| サンプル計算 | ・B = 0.2200, C = 0.1200; ・LPP = [(0.2200–0.1200)*3*1.08*4/3*5 = 2.16 AU |
||
| SPP | (Measurement C) * factors |
x 3 x 1.08 x 10/7 |
x 5 |
| サンプル計算 | ・C = 0.1200; ・SPP = 0.1200*3*1.08*10/7*5 = 2.78 AU |
||
a 略語 : CE, catechin equivalent; IRP, Iron-reactive phenolics; M-3-G, malvidin-3-glucoside; LLP, large polymeric pigment; SPP, small polymeric pigment; AU, absorbance unti. b ピノ・ノワール以外は5倍希釈しました。すべてのIRP計算に20の希釈倍率を使用しました。 c Insert “Abs due tannin” (y) into equation of line from catechin standard curve and solve for x, where y = mx+b and then Tannin = x = (y–b)/m. d Insert “Abs due IRP” (y) into equation of line from catechin standard curve and solve for x, where y = mx+b and then IRP = x = (y–b)/m.
表2. 包括的赤ワインフェノールアッセイの計算概要(Harbertson et al. 2003, Picciotto 2002)
鉄反応性フェノール(IRP)分析
15µLの希釈していないワインサンプルをマイクロプレートウェルに加え、続いて247µLの緩衝液Cを加えました。反応は室温で10分間インキュベートされ、ブランクとして緩衝液Cを用いて510 nmの吸光度が測定されました(IRPバックグラウンド測定)。この後、38μLの塩化第二鉄を各ウェルに添加しました。試薬はマルチチャンネルピペッターで混合しました。反応を室温で10分間インキュベートし、吸光度を510 nmで測定し、ブランクとしてバッファーCを用いました(IRP最終測定)。各サンプル中のIRP量を表2に記載の方法で算出し、mg/Lカテキン当量で表しました。
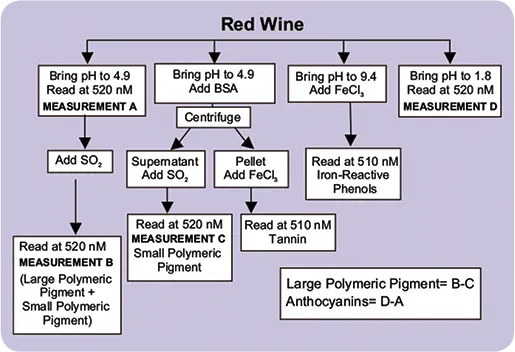
図3. 赤ワインのアッセイ原理
アントシアニン分析
希釈したワインサンプル500 µLを1.5 mLマイクロフュージチューブに加えました。次に、緩衝液Aを1 mL加え、チューブを反転させて試薬を直ちに混合しました。300μLのアリコートをマイクロプレートのウェルに二重に移し、室温で10分間インキュベートしました。ブランクとして緩衝液A を用い、520 nm でMeasurement A を得ました。
希釈したワインサンプル50µLを各ウェルに加え、続いて緩衝液Bを50µL加えました。室温で10分間インキュベートした後、520 nmの吸光度を測定しました(Measurement D)。各ワインサンプル中のアントシアニン量は、表2に記載の方法で算出し、mg/L マルビジン-3-グルコシド(M-3-G)単位で表しました(Picciotto, E.A., et al.)
機器のセットアップ
機器はSoftMax Proソフトウェアでプログラムしました。設定はソフトウェアのプレートセクションで行いました(図4)。
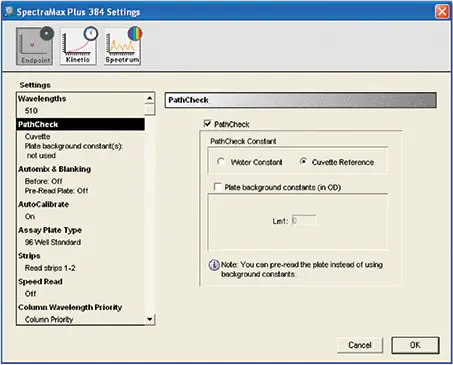
図4. カテキンとタンニンアッセイの機器設定。PathCheck®センサーの設定を示します。反応が非水性(有機)環境で行われた場合は、キュベットリファレンスが選択されました。水性反応の場合は Water Constant を選択しました。
ステップ 1. reading typeはendpointを選択しました。
ステップ2. wavelength optionに適切な数値を入力し、wavelengthを510 nm(タンニン、カテキン、鉄反応性フェノール)または520 nm(measurement A、B、C、D)に設定しました。
ステップ3. "PathCheck "オプションを選択しました。反応が水性環境で行われた場合、"Water Constant "オプションが選択され、ソフトウェアはファームウェアに含まれる定数を使用しました。反応が非水環境で行われた場合は、 cuvette referenceオプションが選択されました。この読み取りの間、有機緩衝液で満たされたキュベットがキュベットポートに挿入されました。機器はキュベットから読み取った値を、経路長の補正に使用しました。
ステップ 4. Automixingが選択されていない。
ステップ 5. autocalibrationにより、機器は選択されたwavelengthに対して自らautocalibrationを行った。
ステップ6. 適切なプレートフォーマット・ウェルが選択されました。
テンプレートのセットアップ
一連の濃度を適切なウェルに配置するためのテンプレートがソフトウェアで設定されました。柔軟なテンプレートレイアウトにより、より多くのサンプルや複製を簡単に追加できます。
図5はカテキン標準曲線用のテンプレートセットアップの例です。残りの分析にも適切なテンプレートを設定しました。
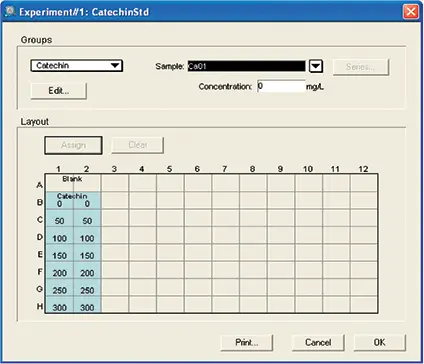
図5. カテキンアッセイ用テンプレートのセットアップ。RS測定用テンプレートのセットアップです。初回プレートにはテンプレートを設定しませんでした。最終プレートブランクには、標準品と未知検体を割り当てました。
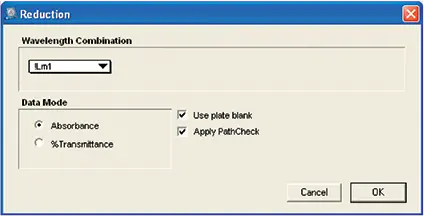
図6. カテキンアッセイのためのReductionセットアップ。最終プレートの同じウェルの光学濃度から初期プレートの各ウェルの光学濃度を差し引くために使用されるカスタム式を示すReductionセットアップです。計算にはPathCheckセンサーの値が適用されました。
測定結果
カテキン標準曲線
カテキンのstandard curve(0~300 mg/mL)をMaterials and Methodsに従って作成しました。SoftMax Proソフトウェアは、ブランクを自動的に差し引き、平均値、標準偏差、%CVを算出しました。また、カテキン濃度に対する510 nmのODのstandard curveをplotし、interpolationでワインサンプル中のタンニン濃度とIRP濃度を算出するために使用しました。ゼロ・カテキン濃度は、group sectionの下にあるsummary lineの下に引き出されていることにご注意(図7)。
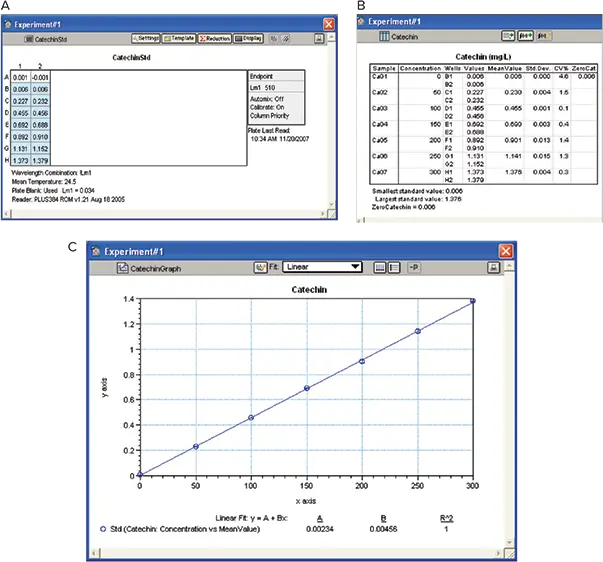
図7. カテキンstandard curve。A:プレートビュー。B:Results。カテキン標準曲線は、タンニンおよびIRP濃度を算出する際のinterpolationに使用しました。
タンニンの分析
タンニンの分析は、「材料と方法」に記載された方法で行いました。タンニンによる光学濃度を以下の式で計算するようにソフトウェアをプログラムしました:
タンニンによる光学濃度 = {(Tannin final)–(Zero catechin)}–(Tannin background * 0.875)
ソフトウエアは、catechin group sectionのsummary lineからカテキンのゼロ濃度のODを利用しました。タンニン濃度は、反応希釈とワインの希釈を考慮した補正係数を適用した後、カテキンstandard curveからinterpolationで計算しました。この例では、ワインを希釈していないため、希釈係数は使用しなかったです(図8)。
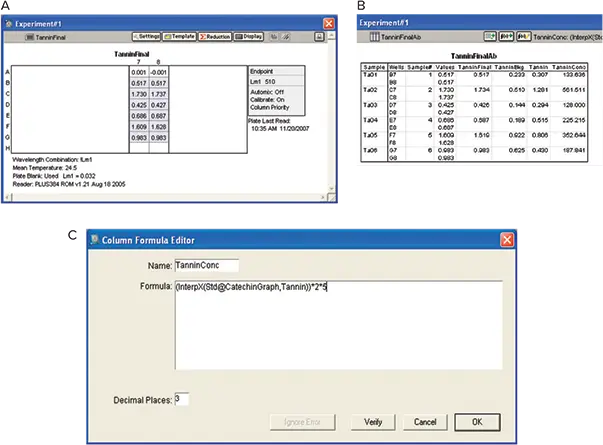
図8. タンニンの分析。A:Plate View。B:結果。OD値はカテキンstandard curveを用いて補間し、タンニン濃度をカスタム式で求めました。
鉄反応性フェノール(IRP)の分析
IRPの分析は、材料と方法のセクションに記載されているように実施しました。IRPによる光学濃度を以下の式で計算するようにソフトウェアをプログラムしました:
IRPによる光学濃度 = {(IRP final)-(Zero catechin)}-(IRP background * 0.875)
ソフトウエアは、カテキングループセクションのsummary lineからカテキン濃度ゼロのODを使用しました。IRP濃度は、ワインの希釈を考慮した補正係数を適用した後、カテキンstandard curveからinterpolationで算出しました(図9)。
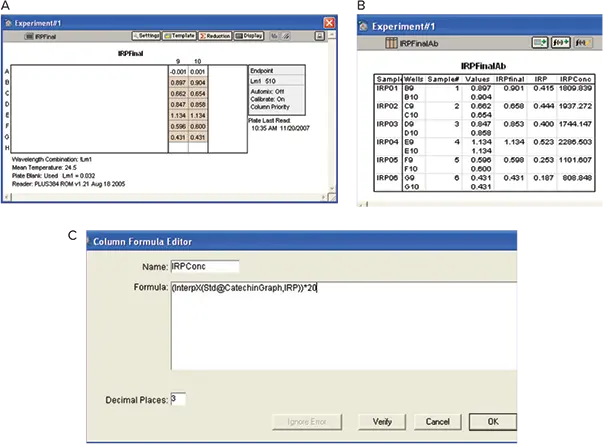
図9. 鉄反応性フェノール(IRP)。A:Plate View。B: Results。カテキンstandard curveを用いてOD値を補間し、カスタム式でIRP濃度を求めました。
アントシアニンの分析
アントシアニンの分析は、Materials and Methodsに記載された方法で行いました。アントシアニンの濃度を以下の式で計算するようにソフトウェアをプログラムしました:
((Measurement D*10)–(Measurement A*5)) /0.0102
ここで、10と5はそれぞれの希釈倍率を表し、0.0102はアントシアニン濃度をマルビジン- 3-グルコシド(M-3-G)単位で表すのに必要な換算係数である(Picciotto, E.A. et al.)(図10)。
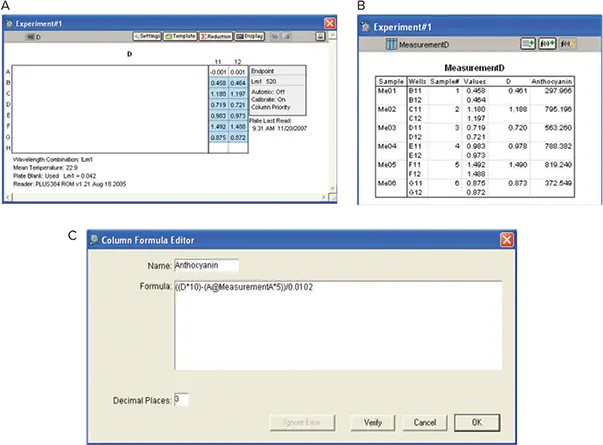
図10. アントシアニンの分析。A:Plate View。B: Results。OD値はカテキンstandard curveを用いて補間し、アントシアニン濃度をカスタム式で求めました。
結論
- SpectraMax Plus 384マイクロプレートリーダーは、Herediaらが96ウェルのマイクロプレートで行った赤ワインフェノール測定に適しています。
- SpectraMax i3x マルチモードマイクロプレートリーダーなど、吸光度検出モードを備えた他のモレキュラーデバイス製プレートリーダーも、このアプリケーションに使用できます。
- マイクロプレートフォーマット利用はコストと時間削減の両面で効果的です。
- SpectraMax Plus 384マイクロプレートリーダーの調整機能とPathCheckセンサー機能は、より高い精度と正確性を実現するのに役立ちます。
- SoftMax Proソフトウェアは、複雑で大規模なデータセットの解析や計算に便利なツールです。あらかじめ書き込まれたすぐに使用できるプロトコル、カスタムプロトコル、適切なグラフオプションが用意されています。
- モレキュラーデバイス StakMax® マイクロプレートスタッカーシステムは、SpectraMaxマイクロプレートリーダーと統合し、20、40、50マイクロプレートのバッチ処理を自動化します。
参考文献
- Harbertson J F et al.; (2002) Am J Enol Vitic 53: 54-59
- Harbertson J F et al.; (2003) Am J Enol Vitic 54: 301-306.
- Harbertson J F et al.; (2004) Am J Enol Vitic 55: 295A.
- Heredia T M et al.; (2006) Am J Enol Vitic 57: 497-502.
- Picciotto E A et al.; (2002) Thesis, University of California, Davis.
PDF版(英語)