Application Note 神経活性化合物のフェノタイプ特性評価
- 創薬においてin vivo環境により近いハイスループット3D培養プラットフォームを活用
- 同一プレート内で機能的フェノタイプ応答と細胞毒性応答を検出
- FLIPR PentaシステムとScreenWorks Peak Pro 2ソフトウェアによるカルシウムオシレーションパターンの解析
PDF版(英語)
Carole Crittenden|アプリケーションサイエンティスト|モレキュラーデバイス
Oksana Sirenko, PhD|シニアリサーチサイエンティスト|モレキュラーデバイス
Cassiano Carromeu, PhD|研究開発ディレクター|StemoniX社
はじめに
より安全で有効な医薬品の開発を加速するために、創薬および毒性スクリーニングにおいて、生物学的に関連性が高く、予測力のある複雑な細胞ベースアッセイのニーズが高まっています。ヒトiPSC由来の神経系3D共培養モデル(StemoniX® microBrain® 3D)は、ヒト皮質脳組織の構成により近いハイスループットスクリーニングプラットフォームとして開発されました。3D神経スフェロイドは、シナプスが豊富な神経ネットワークを含み、高機能な神経回路を形成しており、自発的かつ同期したカルシウムオシレーションを容易に検出可能です。
本技術ノートでは、FLIPR® Penta ハイスループットセルベーススクリーニングシステムを用いたカルシウムオシレーションの複雑な解析手法について紹介します。このシステムでは、振動ピークの検出およびマルチパラメトリックな特性評価が可能です。ScreenWorks® Peak Pro 2ソフトウェアは、カルシウムオシレーションの頻度、ピーク幅、振幅、二次ピークの特性、波形の不規則性、その他複数の出力項目を解析します。さらに、ImageXpress® Micro Confocal ハイコンテントイメージングシステムを用いて、細胞毒性およびミトコンドリア毒性を評価しました。
アッセイの特性評価には、GABA、NMDA、ドーパミンなどの神経伝達物質に作用する既知の作用機序を持つ化合物や薬剤を使用しました。また、既知の神経活性化合物やけいれん誘発性薬剤、選定された環境化学物質の神経毒性プロファイルも評価しました。本研究の結果は、複雑なイベント解析および細胞毒性アッセイと組み合わせることで、神経系3D培養モデルが医薬品および環境毒素の神経毒性評価において、生物学的に関連性の高い正確なシステムとなることを示しています。
材料
- StemoniX microBrain 3Dアッセイレディ384ウェルプレート(StemoniX)
- FLIPR Calcium 6 Assay Kit(モレキュラーデバイス、カタログ番号R8190)
- FLIPR PentaシステムとScreenWorks Peak Pro 2ソフトウェア(モレキュラーデバイス)
- 細胞生存率色素Calcein AM(Invitrogen)
- ミトコンドリア膜電位色素 MitoTracker Orange(Invitrogen)
- ヘキスト核色素(Invitrogen)
- ImageXpress Micro ConfocalシステムとMetaXpress ™ ハイコンテント画像取得・解析ソフトウェア(モレキュラーデバイス)
方法
3D神経培養の培養と染色
StemoniX microBrain 3D Assay Readyプラットフォームは、ヒト脳組織の発達および構成により近いハイスループット3D培養プラットフォームです。このプラットフォームでは、直径約600 µmのヒトiPSC由来神経スフェロイドが使用されており、生理学的に関連性の高い皮質グルタミン酸作動性およびGABA作動性ニューロン(MAP2:緑)とアストロサイト(GFAP:赤)による機能的な共培養系で構成されています(図1参照)。このバランスの取れた細胞構成により、シナプスが豊富な神経ネットワークが形成され、高機能な神経回路が構築されます。microBrain 3Dスフェロイド内の神経細胞は生理学的に活性であり、自発的かつ同期したカルシウム振動を容易に検出できます。
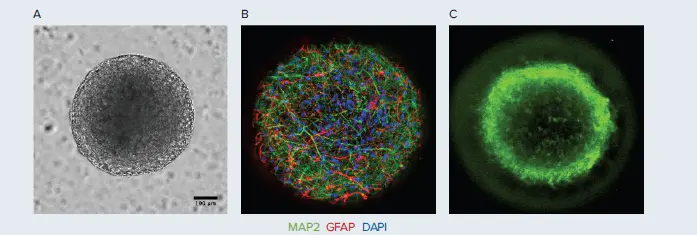
図1. A. ヒトiPSC由来神経スフェロイド(直径約600 µm)は、皮質ニューロン(MAP2で同定、緑)とアストロサイト(GFAPで同定、赤)による共培養で構成されています。B. ImageXpress Micro Confocalシステムを用いて20倍対物レンズでイメージングされた活性皮質ニューロンとアストロサイト。C. カルシウム色素で染色された神経スフェロイド。
StemoniX microBrainプレートは常温で播種済みの状態で出荷されます。各ウェルには、8〜12週間成熟した均一サイズのヒトiPSC由来皮質神経スフェロイドが1つ含まれています。製造元の指示に従い、到着当日にプレートを200×gで5分間遠心し、スフェロイドがウェル底部に沈降していることを顕微鏡で確認後、70%エタノールで除染し、シールを除去しました。その後、培地を半量ずつ3回交換し、プレートを37°C、5% CO₂のインキュベーターに5〜7日間設置しました。培地交換は隔日で行いました。
FLIPR Pentaシステムによるカルシウムオシレーションパターンの評価
FLIPR Pentaシステムは、高速EMCCDカメラと新しいScreenWorks Peak Pro 2ソフトウェアを搭載しており、ヒトiPSC由来心筋細胞および神経細胞における複雑なカルシウムオシレーションパターンの測定と解析が可能です。
本研究では、FLIPR® Calcium 6 Assay Kitを用いて、神経スフェロイドの細胞内カルシウム濃度変化をモニタリングしながら、FLIPR Pentaシステムの高速EMCCDカメラでカルシウムオシレーションのキネティックパターンと頻度を測定しました。ScreenWorks Peak Pro 2ピーク解析ソフトウェアモジュールにより、一次および二次ピーク、複雑なオシレーションパターンの解析と特性評価が可能です。
細胞内カルシウムフラックスの評価は、Sirenko, Grimmほか(2017)に記載された方法に従い、FLIPR Calcium 6 Assay Kitを使用して実施しました。励起波長470–495 nm、蛍光検出波長515–575 nmで、2 Hzの頻度で10分間測定しました。カメラ感度は「Normal」、露光時間は0.05秒、読み取り間隔は0.5秒、カメラゲインは6.5、LED励起強度は30%に設定しました。装置温度は一定の37°Cに維持しました。化合物曝露後60分時点でカルシウムオシレーションへの初期影響を測定しました。初期タイムポイントでは、化合物添加の2時間前にFLIPR Calcium 6色素を細胞にプレロードしました。化合物未添加時のカルシウムオシレーションベースラインは、化合物添加前に測定しました。24時間のカルシウムオシレーションおよびイメージング実験では、化学物質を適切な濃度で22時間曝露した後、FLIPR Calcium 6色素(4倍濃度)を追加し、さらに2時間インキュベートしました。化合物濃度を維持するために、色素添加時に化合物も追加しました。
ImageXpress Micro Confocalシステムによるスフェロイドの形態および生存率評価
共焦点イメージングおよび3D画像解析手法を用いて、3D神経スフェロイドに対する化合物の形態および生存率への影響を評価しました。細胞毒性の評価には、各種化合物を24時間処理した後、Hoechst核染色、Calcein AM、MitoTracker Orange(ミトコンドリア膜電位色素)によるライブ染色を行いました。画像はImageXpress Micro Confocalシステムの共焦点オプションと3Dイメージング機能を用いて取得しました。
結果
FLIPR Pentaシステムによるカルシウムオシレーションの評価
microBrain 3Dスフェロイド内の神経細胞は、自発的かつ同期したカルシウムオシレーションを生成します。FLIPR Pentaシステムによるキネティック蛍光イメージングを用いて、FLIPR Calcium 6 Assay Kitでモニタリングされた神経スフェロイドのカルシウムオシレーションパターンと頻度を測定しました。 NMDA、GABA、AMPA受容体のアゴニストおよびアンタゴニスト、カイニン酸、抗てんかん薬など、既知の神経調節薬を評価しました。
ImageXpress Micro Confocalシステムで記録されたカルシウムオシレーションのタイムラプス画像の一部は図2に示されています。定量的評価には、以下の代表的な記述子が使用されました:ピーク数(10分あたり)、平均ピーク振幅、平均CTD90ピーク幅(ピーク振幅の90%での幅)、平均ピーク間隔(ピーク間の時間)、平均ピーク立ち上がり時間(90%→10%振幅)、平均ピーク減衰時間(10%→90%振幅)、ピークの不規則性。本実験では、評価パラメータとして「10分あたりのカルシウムオシレーション数」と「ピーク振幅」を使用しました。オシレーションパターンは大きく異なり、以下のように分類・特性評価されました:神経伝達物質(図3)、神経活性化合物(図4)、潜在的神経毒性化合物(図5)。代表的なピーク数およびピーク振幅の濃度依存性応答曲線は図6に示されています。毒性データと組み合わせることで、フェノタイプ応答パターンの構築が可能です。

図2. ImageXpress Micro Confocalシステムで取得された、時間経過に伴うカルシウムオシレーションの様子。
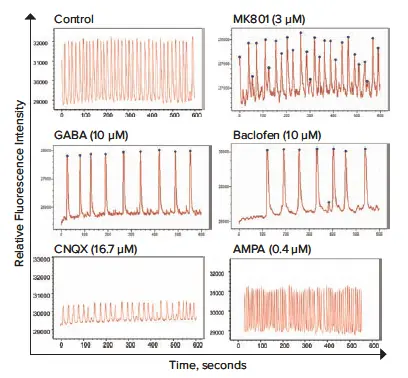
図3. カルシウム感受性色素を用いて、神経スフェロイドにおける細胞内Ca²⁺オシレーションの頻度とパターンに対する各種神経伝達物質および関連化合物の影響を評価。FLIPR Pentaシステムによる高速EMCCD蛍光イメージングを用いて、コントロールと比較して測定。
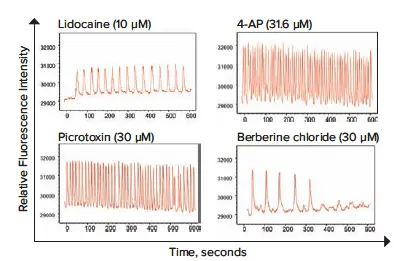
図4. 図3と同様の方法を用いて、3種類の神経活性化合物を試験し、オシレーションパターンの頻度と振幅におけるフェノタイプ変化を観察。
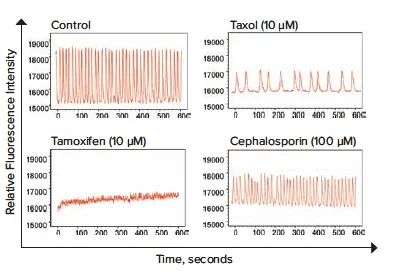
図5. 神経毒性の可能性がある化合物で処理した神経スフェロイドにおけるカルシウムオシレーションパターン。
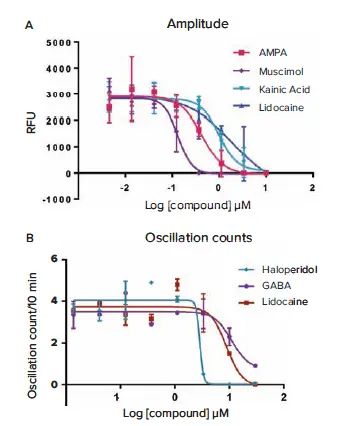
図6a. 一部の化合物に対して得られた平均オシレーション振幅に基づく濃度依存性応答曲線。IC₅₀値は以下の通り:AMPA:0.42 µM、ムスシモール:0.14 µM、カイニン酸:0.98 µM、リドカイン:1.9 µM。図6b. 他の化合物に対して得られた10分間あたりの平均オシレーション数に基づく濃度依存性応答曲線。IC₅₀値は以下の通り:ハロペリドール:約2.8 µM、GABA:11.1 µM、リドカイン:8.9 µM。
ハイコンテントイメージングによるスフェロイドの生存率および形態評価
化合物処理後、神経スフェロイドはDAPI、FITC、TRITCフィルターを用いた10X Plan Fluor対物レンズでイメージングされ、10 µm間隔で20枚の共焦点Zスタック画像を取得しました。最大投影画像は、Custom Module EditorおよびCell Scoringアルゴリズムを用いて解析され、全細胞数、生存細胞数(Calcein AM陽性)、ミトコンドリアが健常な細胞数(MitoTracker陽性)を検出しました。これらの解析手法は、細胞およびスフェロイドの形態特性評価に有効なツールです。コントロールおよびクロルプロマジン処理群の結果例は図7に示されています。
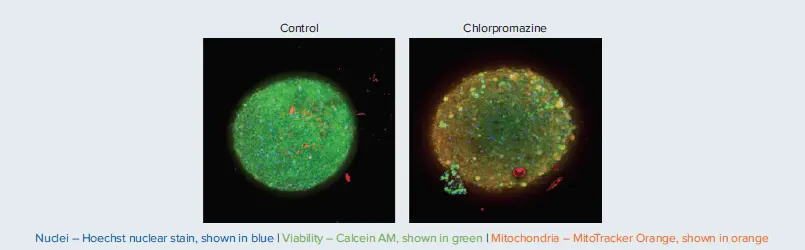
図7. 神経スフェロイドの合成投影画像。各スフェロイドは、指定された化合物を30 µMで24時間処理後、核染色(Hoechst 33342)、生存率染色(Calcein AM)、ミトコンドリア膜電位色素(MitoTracker Orange CMTMRos)で2時間染色(それぞれ2 µM、1 µM、0.5 µM)。
カルシウムオシレーションの記述子データとイメージングによる生存率データを組み合わせることで、microBrain 3Dスフェロイド内の神経細胞に対する化合物の影響を示すフェノタイププロファイルが構築されます。化合物の種類に応じて、ピーク高さまたはピーク数のEC₅₀またはIC₅₀値、濃度によるカルシウムオシレーションの変化の発現タイミング、生存率などの情報をもとに、化合物のフェノタイプ特性評価が可能です(表1)。
|
ピーク カウント 1 |
振幅 減少 1 |
発振周波数 |
細動* |
発振停止 * |
振幅不規則* |
ピーク間隔の不規則性* |
二次ピーク |
細胞毒性 |
ミトコンドリア毒性 |
最大濃度 |
説明 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 神経伝達物質 | ||||||||||||
| MK-801 | 10.2 | 0.28 | 下 | 0.03 | 0.03 | 0.03 | 10 | NMDA拮抗薬、チャネル遮断薬 | ||||
| GABA | ~15 | 3.56 | 下 | 3 | 3 | 0.03 | 10 | 内因性作動役 | ||||
| バクロフェン | ~2 | 下 | 3 | 0.03 | 10 | ギャバB作動薬 | ||||||
| CNQX | 10.2 | 下 | 15 | 15 | 0.03 | 50 | ギャバB作動薬 | |||||
| AMPA | ~0.2 | 0.48 | 上 | 1 | 0.3 | 0.3 | 0.03 | 10 | AMPAアゴニスト | |||
| コントロールDMSO | 無効 | 無効 | 無効 | 無効 | 無効 | 無効 | 無効 | 無効 | 無効 | 無効 | 無効 | |
| 神経活性化合物 | ||||||||||||
| リドカイン | 6.8 | 5.7 | 下 | 30 | 1 | 1 | 0.03 | 30 | Naチャネル遮断剤 | |||
| 4-AP | 3.4 | 無効 | 上 | 30 | 3 | 3 | 0.03 | 30 | 覚醒剤 | |||
| ピクロトキシン | 29.5 | 1.28 | 上 | なし | 0.03 | 30 | 覚醒剤、解毒剤 | |||||
| 神経毒性化合物の可能性 | ||||||||||||
| 第2コントロール | ||||||||||||
| タキソール | 9.15 | >30 | 下 | 10 | 3 | 0.03 | 100 | 100 | 100 | 抗がん剤 | ||
| タモキシフェン | 6.43 | 3.59 | 下 | 30 | 30 | 0.03 | 100 | 100 | 100 | エストロゲン受容体モジュレーター | ||
| セファロスポリン | ~100 | 100 | 30 | 0.03 | 抗生物質 | |||||||
表1. 各出力項目に対して、IC₅₀またはEC₅₀値(①)、または特定の変化を引き起こす最小濃度(µM)(*)を示しています。変化が見られなかった項目は空欄で表示。
結論
本研究では、iPSC由来StemoniX microBrain 3D Assay Ready神経培養プラットフォームを用いた化合物評価アッセイ手法を開発し、FLIPR Pentaシステム上での実施可能性を示しました。既知の神経調節薬、神経活性薬、神経毒性薬による機能的応答は、ScreenWorks Peak Pro 2解析ソフトウェアを用いて測定されました。カルシウムオシレーションのピークパターンと、ImageXpress Micro Confocalシステムによる神経毒性の早期検出を組み合わせることで、ハイスループットスクリーニングに有用なフェノタイプ特性評価プロファイルが構築されました。
詳細情報について
- O. Sirenko, C. Carromeu, et al., Functional and Mechanistic Neurotoxicity Profiling Using Human iPSC-Derived Neural 3D Cultures, Toxicological Sciences, Volume 167, Issue 1, January 2019, Pages 58-76.
- O. Sirenko, FA Grimm, et al., in vitro cardiotoxicity assessment of environmental chemicals using an organotypic human induced pluripotent stem cell-derived model. Toxicology and Applied Pharmacology, Volume 322, 1 May 2017, Pages 60-74.
PDF版(英語)