Application Note iPS細胞から分化誘導された
心筋細胞における毒性化合物の表現型的影響評価
- 自動画像処理による心毒性効果の評価
- 定量的画像解析を用いた細胞生存率と心毒性の判定
- 化合物の心毒性の濃度反応を評価
PDF版(英語)
はじめに
Oksana Sirenko, PhD|Research Scientist|モレキュラーデバイス|カリフォルニア州サニーベール
心毒性は、臨床試験中および市販後における薬剤の使用中止の主な原因です *1。心血管疾患のかなりの割合が環境暴露に起因すると考えられていますが、原因となる環境因子の同定はほとんど行われていません *2。従って、in vitroスクリーニングのためのアッセイ開発の重要なターゲット領域には、潜在的な心毒性作用の検出が含まれます。
初代心筋細胞や心筋組織調製に代わるものとして、ヒト人工多能性幹細胞(iPSC)由来のin vitroモデル系が、生理学的に適切で再現性の高い心毒性試験の選択肢として浮上してきました *3,* 4。心筋細胞は同期して拍動する単分子層を形成し、薬剤に関連した心生理学的表現型を確実に再現します。この表現型は、細胞内Ca2+フラックスの変化をモニターする高速カイネティック蛍光アッセイによって評価することができます *5。拍動プロファイルの変化を評価することは、機能的効果を検出するために非常に重要であり、ハイコンテントイメージングは、形態学的変化や化合物の細胞毒性効果をモニタリングするために不可欠な補完的アッセイです。
材料
- ImageXpress Nano自動イメージングシステムとCellReporterXpress自動画像取得・解析ソフトウェア(モレキュラーデバイス)
- iCell ® 心筋細胞(Cellular Dynamics International)
- AFF88標識ファロイジン(サーモフィッシャーサイエンティフィック)
- MitoTracker Orange(サーモフィッシャーサイエンティフィック)
- Hoechst(サーモフィッシャーサイエンティフィック)
- 384ウェルマイクロプレート(コーニングライフサイエンス)
方法
本研究では、幹細胞由来の心筋細胞を用いたハイスループットスクリーニングアッセイにおけるImageXpress Nano自動イメージングシステムの効率性を評価しました。iPSC由来心筋細胞は、心毒性に関連する医薬品および環境化学物質パネルの試験に使用しました。ヒトiPSC由来心筋細胞(iCell®心筋細胞)、プレーティング培地、および維持培地は、Cellular Dynamics International社から提供されました。細胞のプレーティングと維持は、製造元の推奨に従って行いました *6。細胞は384ウェルプレートに8,000個/ウェルでゼラチンコートしたウェルにプレーティングしました。心筋細胞単層の同期収縮は、培養5-7日後に明らかになりました。
自動イメージングによる心毒性評価
心毒性を評価するために、細胞を様々な心毒性化合物で24時間処理した後、生存率を評価するためにCalcein AM、核を検出するためにHoechst 33342、インタクトなミトコンドリアを検出するためにMitoTrackerオレンジ色素で生きた細胞を染色しました(それぞれ最終濃度0.5μM、2μM、1μM)。画像はImageXpress Nano自動イメージングシステムで取得し、CellReporterXpress™自動画像取得・解析ソフトウェアのCell Scoringまたは細胞生存率アプリケーションモジュールを用いて処理・定量化しました。読み取り値には、Hoechst 33342の核数と強度、Calcein AM染色陽性の生細胞のパーセンテージと総面積、MitoTracker Orange色素陽性の細胞数が含まれました。
生細胞イメージング後、細胞を4%ホルムアルデヒドで固定し、細胞の細胞骨格の完全性を調べるためにAF-488ファロイジン(1:100希釈)で再染色しました。画像はCell Scoringアルゴリズムを用いて解析し、心筋細胞の総面積および平均面積、ならびに無傷の細胞骨格を有する細胞数および割合を定量化しました。化合物は0.3、1.0、3.0、10、30、100μMで二重にテストしました。DMSOコントロール(n=12)と未処理コントロール(n=4)が各プレートに含まれました。0.3%までのDMSOを用い、アッセイ内での溶媒効果を評価しました。細胞は37℃、5% CO2で24時間化合物に暴露されました。384ウェルフォーマットでのプレーティング密度の最適化に関する詳細は、Grimm et al. *4
画像は10倍のPlan Fluor対物レンズを用いて取得しました。384ウェルプレートの1ウェルにつき1枚の10倍画像を撮影しました。10倍の対物レンズは、細胞骨格組織、細胞間円板などの細胞接合部、細胞内構造を識別するのに十分な解像度を提供し、同時にウェル内の比較的多くの細胞を捉えることができます。10倍の1視野(1.28 x 1.28 mm)で最大2,000個の細胞を捉えることができ、これはウェル全体の面積(2.67 x 2.67 mm)の約1/4に相当します。図1は、コントロール細胞と化合物処理細胞の代表的な画像から得られた画像処理の例を示しています。
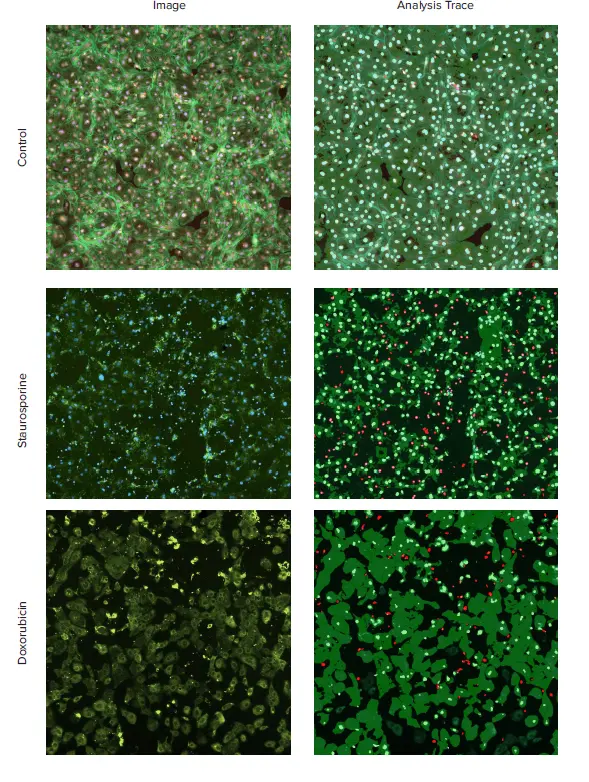
図1. 心毒性の可視化のための心筋細胞の細胞骨格染色。iCell心筋細胞をプレーティングし、化合物で24時間処理した後、Hoechst(2μM)、MitoTracker Orange(1μM)の組み合わせで染色し、AF488標識ファロイジン(1:100)で固定・染色しました。画像はImageXpress Nanoシステムで10x Plan Fluor対物レンズを用い、DAPI、TRITC、FITCチャンネルで撮影しました。画像はCell Scoring解析アルゴリズムを用いて処理しました。アクチン、Hoechst、MitoTracker Orangeの合成画像(左)および解析トレース(右)を、コントロールおよび選択化合物処理細胞について示します。指定化合物(スタウロスポリン、1μMおよびドキソルビシン、10μM)で処理した心筋細胞では、細胞骨格の破壊と細胞死が観察されました。
定量的画像解析による細胞生存率と心毒性の判定
我々は、選択した化合物が生存細胞数(カルセインAM陽性またはAF-488陽性)に及ぼす影響を観察しました(図2)。画像の定量的解析には、細胞骨格やミトコンドリアの完全性、接着細胞の領域を評価できるその他のパラメーターの導出も含まれました。特異性では、形態学的変化(細胞面積の減少など)が観察されました(デルタメトリン、アステミゾールなど)。スタウロスポリンでは、核面積の減少と核強度の増加が観察されました(アポトーシスの徴候)。細胞毒性を示す化合物では、MitoTracker Orange染色の減少も観察されました。化合物の毒性作用は、生存細胞数または総細胞面積の 4-parametric curve fitsから得られたEC50値(カルセインAMまたはファロイジン陽性細胞の50%減少に対する化合物の濃度)によって評価しました。他のパラメータは、高濃度では濃度依存的な変化を示したが、4-parameter curveでは信頼できるフィット処理ができなかったです。
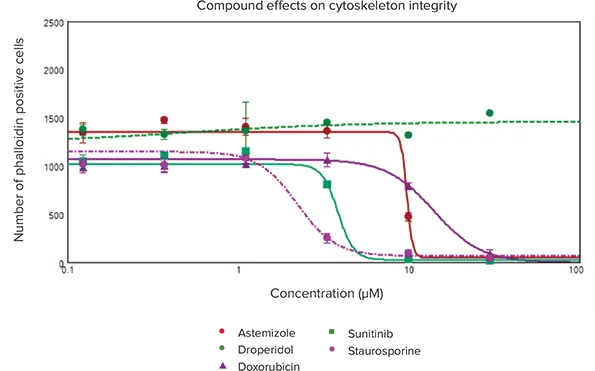
図2. ファロイジンで染色した生存心筋細胞の用量反応曲線。細胞生存能は、化合物処理によって誘導された細胞骨格の完全性に対する細胞毒性効果を解析することによって決定しました。CellReporterXpressソフトウェアのCell Scoring解析アルゴリズムを用いて、ファロイジン陽性染色(アクチンは緑色に染色)の生存細胞総数の観察を定量化しました。Concentration-dependent response curvesを4-parameter curve fits処理でplotし、表1に示すEC50値を得ました。
化合物心毒性の濃度反応評価
化合物効果のEC50値を表1に示します。テストした22種の化合物のうち、9種は細胞生存率を低下させ、総面積も低下させました。バリノマイシンとロテノンは、生細胞の総数で決定される毒性作用が最も強かったです(EC50値は1μM未満)。メチル水銀とテトラエチルチウラムジスルフィドも強い毒性効果を示しました(EC50値はそれぞれ3μMと15μM)。心毒性作用が知られているいくつかの薬剤(スタウロスポリン、スニチニブ、アステミゾール、ドキソルビシン、塩化ベルベリン)も、EC50値が1~15μMの範囲で、比較的顕著な毒性作用を示しました。デルタメトリンとトルエンの影響は比較的軽微でした(EC500値は決定されなかった)。その他のテスト化合物は細胞毒性作用を示さなかったです。
|
化合物(EC50値、μM) |
陽性細胞数 | 陽性細胞総面積 |
|---|---|---|
| スタウロスポリン | 1.29
* |
2.83 |
| スニチニブ | 4.05 | 4.83 |
| 塩化ベルベリン | 7.08 | 3.96 |
| アステミゾール | 9.74 | 9.41 |
| ドキソルビシン | 14.02 | >30 |
| ドロペリドール |
効果なし ** |
効果なし |
| アミトリプチリン | 効果なし | 効果なし |
| パクリタキセル | 効果なし | 効果なし |
| イマチニブ | 効果なし | 効果なし |
| ブスルファン | 効果なし | 効果なし |
| バリノマイシン | 0.057 | 0.053 |
| ロテノン | 0.111 | 0.106 |
| メチル水銀 | 3.08 | 2.86 |
| テトラエチルチウラムジスルフィド | 15.2 | 12.8 |
| デルタメトリン |
>100 *** |
128 |
| トルエン | >100 | >100 |
| テトラブチルフェニル | 効果なし | 効果なし |
| リン酸ジフェニル | 効果なし | 効果なし |
| サリドマイド | 効果なし | 効果なし |
| トリクレジルホスフェート | 効果なし | 効果なし |
| トリフェニルホスフェート | 効果なし | 効果なし |
| サッカリン | 効果なし | 効果なし |
| ロイシン | 効果なし | 効果なし |
* 細胞骨格がインタクトな細胞数または総面積を読み取り値として、試験化合物について測定したEC50値(μM単位)。 ** 「100以上」は、試験した最高濃度(100μM)で毒性作用(陽性細胞数または総細胞面積の減少)が観察されたことを意味しますが、EC50値は決定していません。 *** 「効果なし」は、試験した最高濃度(100μM)で明らかな効果が観察されなかったことを意味します。
表1. 試験化合物について測定した細胞毒性作用のEC50値。EC50値は、4-parameter curve fit処理でplotした用量依存性反応曲線からHillモデルに基づいて作成しました。曲線は、ファロイジン陽性細胞(生存細胞)の総数と総面積について作成しました。
サマリー
このアッセイは、複数の化学物質の心毒性をハイスループットでスクリーニングするためのImageXpress NanoシステムとCellReporterXpressソフトウェアの効率性と信頼性を実証するものです。このスクリーニング・ツールは、薬剤開発の初期段階での心毒性薬剤の同定を可能にし、ヒトにおける潜在的な薬剤の心毒性作用を試験するための信頼性の高いツールをご提供します。
参考文献
- Berridge BR, Hoffmann P, Turk JR, Sellke F, Gintant G, Hirkaler G, Dreher K, Schultze AE, Walker D, Edmunds N, Halpern W, Falls J, Sanders M, Pettit SD. Integrated and translational nonclinical in vivo cardiovascular risk assessment: Gaps and opportunities. (2013) Regul Toxicol Pharmacol 65:38-46
- Pruss-Ustun A, Corvalan C. Preventing disease through healthy environments: Towards an estimate of the environmental burden of disease. (2006). Geneva, Switzerland:World Health Organization
- Anson BD, Kolaja KL, Kamp TJ. Opportunities for use of human ips cells in predictive toxicology. (2011) Clin Pharmacol Ther 89:754-758
- Grimm FA, Iwata Y, Sirenko O, Bittner M, Rusyn I. High-content assay multiplexing for toxicity screening in induced pluripotent stem cell-derived cardiomyocytes and hepatocytes. (2015) Assay Drug Dev Technol 13:529-546
- Guo L, Abrams RM, Babiarz JE, Cohen JD, Kameoka S, Sanders MJ, Chiao E, Kolaja KL. Estimating the risk of drug-induced proarrhythmia using human induced pluripotent stem cell-derived cardiomyocytes. (2011) Toxicol Sci 123:281-289
- Sirenko O, Cromwell EF, Crittenden C, Wignall JA, Wright FA, Rusyn I. Assessment of beating parameters in human induced pluripotent stem cells enables quantitative in vitro screening for cardiotoxicity. (2013b) Toxicol Appl Pharmacol 273:500-507
PDF版(英語)