Application Note 蛍光を利用した安定で高感度なサイクリックGMP測定法
PDF版(英語)
はじめに
Janet Daijo , Anne T. Ferguson:モレキュラーデバイス, David Morton:Sunnyvale, CA, USA. 2 オレゴン健康科学大学、オレゴン州ポートランド Email: mortonda@ohsu.edu
3´, 5´環状グアノシン一リン酸(cGMP)は、シグナル伝達経路における二次メッセンジャーであり、酵素グアニリルシクラーゼ(GC)によって産生されます。サイクリックGMPシグナル伝達は、平滑筋の弛緩、陰茎の勃起、腎機能、炎症反応など多くの生理的反応において重要です *1, *2, *3。また、脊椎動物と無脊椎動物の光伝達には、グアニル酸シクラーゼ活性を制御するシグナル伝達経路が関与しています *4, *5。
本報告では、新しいcGMPアッセイ(CatchPoint™ cGMP Fluorescent Assay Kit)を用いて、2つのモデル系でGC活性を測定した結果を示します。最初のモデル系は、心房性ナトリウム利尿ペプチド(ANP)*6, *7というポリペプチドホルモンによるGCの活性化です。このホルモンは脊椎動物の多くの種に見られ、血圧上昇に反応して放出されます。ANPは、腎臓からのナトリウムと水分の排泄を促し、血管平滑筋を弛緩させることによって血圧を下げます。私達は、ラット肺線維芽細胞株RFL-6におけるANPの活性を研究しています。
二つ目のモデル系では、タバコの角虫Manduca sexta 8-10の中枢神経系に局在する新規GC、MsGC-β3の活性を研究しています。NOによるヘテロ二量体形成と活性化を必要とする他の可溶性GCとは異なり、MsGC-β3は、COS-7細胞で単独発現させると高い基礎活性を示し、一酸化窒素存在下ではわずかな刺激しか示さないという点でユニークです *9。
これら2つのモデル系でcGMPを測定するために使用されるcGMPアッセイは、モレキュラーデバイスのCatchPoint cGMP Fluorescent Assay Kit(cat #R 8044, R 8053)と同じ原理に基づく競合イムノアッセイです。つまり、サンプル中のcGMP量が増加すると、蛍光シグナル出力は減少します。本レポートでは、本アッセイの高感度、高信頼性、簡便性を示します。
材料
- 細胞 RFL-6ラット肺線維芽細胞(ATCC)は、20%ウシ胎児血清、グルタミン(2 mM)、ペニシリン(50 U/mL)およびストレプトマイシン(10 mg/mL)を添加したHam's F-12培地で増殖させました。COS-7サル腎臓細胞(ATCC)は、10%FCS添加DMEMで培養しました。
- 試薬 凍結乾燥cGMPキャリブレーター、ウサギ抗cGMP抗体、HRP-cGMPコンジュゲートおよびStoplight Red™基質を含むCatchPoint cGMP Fluorescent Assay Kit(モレキュラーデバイス、cat #R8074、96ウェルアッセイキット)、炭酸水素ナトリウム(Sigma)、ヒトANP(Sigma)、ウシ血清アルブミン、BSA30%(Sigma)、ホスホジエステラーゼ阻害剤、3-イソブチル-1-メチルキサンチンまたはIBMX(Sigma)、EDTAを含まない完全プロテアーゼ阻害剤(Roche Applied Science)および30%過酸化水素(H202)溶液(Sigma)。
- マイクロプレート。コート済み黒壁透明底96ウェルマイクロプレート(キットに付属)、12ウェル透明組織培養処理マイクロプレート(VWR)。
- 培地とバッファー Ham's F-12 medium (Irvine Scientific), DMEM (Irvine Scientific), fetal bovine serum (Irvine Scientific), glutamine pen-strep solution (Irvine Scientific), Krebs-Ringer bicarbonate buffer (KRGB buffer) (Sigma), M-PER mammalian cell extraction reagent (Pierce)、リン酸緩衝生理食塩水、PBS(Invitrogen™ Life Technologies)。Cell Lysis Buffer (pH 7.3)、cGMP Assay Buffer (pH 5.8)、10X Wash Solution はすべてキットに付属しています。
試薬の調製
| cGMP キャリブレーター | 3x 原液(nM) | 最終濃度(nM) 1 |
|---|---|---|
| 10,000 | 3333 | |
| 100 | 33 | |
| 33 | 11 | |
| 11 | 3.7 | |
| 3.7 | 1.2 | |
| 1.2 | 0.41 | |
| 0.4 | 0.14 | |
| 陰性コントロール(PBS) | 0 | 0 |
表1: 標準用量反応曲線の作成に使用したcGMPキャリブレーターの用量。1アッセイ容量120 µL中の最終濃度。
| ANP | 3x 原液(nM) | 最終濃度(nM) 1 |
|---|---|---|
| 9,000 | 3000 | |
| 3000 | 1000 | |
| 900 | 300 | |
| 300 | 100 | |
| 90 | 30 | |
| 30 | 10 | |
| 9 | 3 | |
| 3 | 1 | |
| 0.9 | 0.3 | |
| 0.3 | 0.1 | |
| 0.09 | 0.03 | |
| 陰性コントロール(PBS) | 0 | 0 |
表2: 細胞を用いた実験に使用したANPの用量。1アッセイ容量600μL中の最終濃度。
- KRGB バッファー。シグマ社では、製品情報シートにこのバッ ファーの詳しい調製方法を記載しています。
- 800 mM IBMX。100 mg の IBMX を 563 µL の DMSO に溶かす。20℃で保存します。IBMXはcGMP-ホスホジエステラーゼによるcGMPの分解を阻害します。
- 刺激前バッファー。800mMのIBMX 9.4μLをKRGBバッファー10mLに加える。IMBXが完全に溶解するように激しくボルテックスする。この緩衝液は実験当日に新しく調製します。
- cGMP キャリブレーター。凍結乾燥キャリブレーター 1 バイアルを PBS 5 mL に溶解します。この結果、cGMPキャリブレーター濃度は30µMとなります。内容物がすべて溶解するようによく混ぜます。氷上または4℃で保管してください。表1に示すように、cGMPアッセイバッファーでさらに希釈します。
- 60 µM ANP。100 µg ANP を 0.1% BSA 添加滅菌 PBS 541 µL に溶解します。分注し、-20℃で保存します。表 2 に示すように、0.1% BSA を含む PBS でさらに希釈します。
- 再構成ウサギ抗cGMP抗体およびHRP-cGMPコンジュゲート。cGMPアッセイバッファーを10mLずつ2つのバイアルに加え、よく混ぜて内容物を溶かし、氷上または4℃で2週間まで保存します。
- ストップライトレッド基質溶液。この溶液は使用前に新しく調製し、調製後1時間以内に加えます。100XストックStoplight Red基質150 µLを基質バッファー15 mLに希釈し、3%過酸化水素17 µLを加えます。溶液は遮光してください。
方法
cGMP キャリブレーターを用いた CatchPoint cGMP Fluorescent Assay Kit(モレキュラーデバイス、cat #R8074)の使用法の詳細は、キットに添付されている製品 添付文書に記載されています。
RFL-6細胞研究のための細胞調製
ステップ1 RFL-6細胞を1mL中7.5 x 104 cells/mLで12ウェル組織培養処理マイクロプレートのウェルに播種しました。細胞を5%CO2中、37℃で一晩培養しました。
ステップ2 翌日、細胞を封じ込めたウェルを静かに吸引し、400μLの刺激前バッファーで10分間インキュベートしました。200μLのANPストック溶液またはPBS(表2参照)を細胞を封じ込めたウェルに加え、37℃で15分間インキュベートしました。
ステップ3 細胞を溶解するために、200μLのセル溶解バッファーを各ウェルに加え、プレートシェーカーを用いてマイクロプレートを室温で10分間撹拌しました。
ステップ4 マルチチャンネルピペッターを用いて、各ウェルから40µLずつ取り出し、96ウェルプレートの別々のウェルに移しました。12ウェルプレートの各ウェルは、96ウェルアッセイマイクロプレートの4重反復に使用しました。
COS-7細胞研究のための細胞調製
ステップ1 コントロールpcDNA3.1プラスミド(Invitrogen)またはpcDNA3.1にクローニングされたMsGC-β3コード配列で、COS-7細胞をトランスフェクトしました *8。
ステップ2 トランスフェクションの3日後、細胞を回収し、EDTAフリーのCompleteプロテアーゼ阻害剤を含むM-PER抽出試薬中でホモジニアス化しました。
ステップ3 COS-7細胞抽出物を、50mM MOPS-KOH(pH7.5)、60mM KCl、8mM NaCl、4mM MgCl2または4mM MnCl2、cGMPホスホジエステラーゼ阻害剤ジピリダモールとザプリナスト各10mM、および1mM GTPを封じ込めたバッファー中で30分間インキュベートしました。
ステップ4 反応を0.2M酢酸亜鉛で停止し、過剰のGTPを0.2M Na2CO3で沈殿させました。サンプルを遠心分離し、上清を CatchPoint Assay Buffer で希釈しました(1:40 希釈)。
ステップ 5 マルチチャンネルピペッターを用いて、各ウェルから 40 µL ずつ取り出し、96 ウエルプレートの別々のウエルに移し、各サンプルを重複してアッセイしました。サンプルはTK CatchPointアッセイを用い、比色分析アッセイも並行して実施しました *11。
CatchPoint cGMPアッセイ法の手順
ステップ 1 再構成したウサギ抗cGMP抗体40マイクロリットルを全てのウェルに添加しました。マイクロプレートをプレートシェーカーで 5 分間静かに撹拌し、適切にプレーティングします。
ステップ2 再構成したHRP-cGMPコンジュゲート40マイクロリットルをマイクロプレートの全ウェルに添加し、穏やかに混合しました。その後、プレートを室温で2時間インキュベートしました。
ステップ3 インキュベーションが完了したら、アッセイマイクロプレートを1回につき300μLの洗浄バッファーで4回洗浄しました。
ステップ4 100μLのStoplight Red基質溶液を各ウェルにできるだけ速やかに添加しました。マイクロプレートは蓋をして遮光しました。
ステップ 5 60 分後、CatchPoint cGMP 製品添付文書に記載されている設定で蛍光強度を測定しました。蛍光はAnalyst™ AD、FlexStation™ またはGemini XSシステムを用いて測定しました。
測定結果
アッセイ性能
サイクリックGMPキャリブレーター
最初にcGMPキャリブレーターを用いてアッセイ性能を調べました。cGMPキャリブレーターの各濃度は4重反復で行いました。3回以上の実験の代表的な結果を図1に示します。3種類の蛍光マイクロプレートリーダーをすべて使用して 得られたEC50値の範囲は、1.7~2.8 nMでした。SB比の範囲は、ゼロキャリブレーター濃度と3333 nMキャリブレーター濃度を用いて計算しました。Analystで得られた値は300から340の間、Gemini XSで得られた値は420から430の間、FlexStationで得られた値は400から480の間でした。
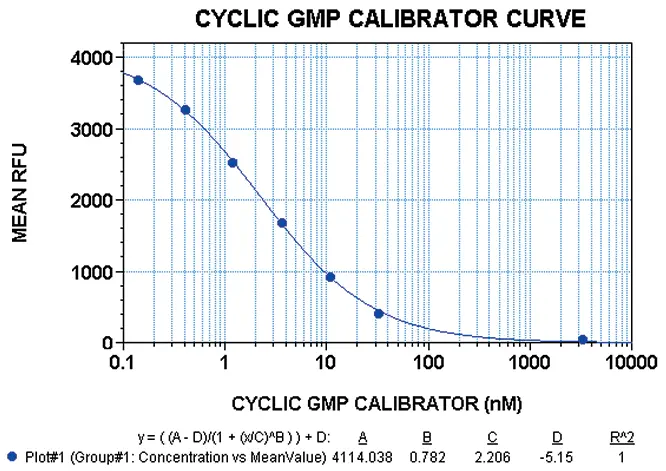
図1:FlexStationを用いたcGMPキャリブレーターの用量反応曲線。データはStoplight Red基質添加の60分後に得られました。グラフの各ポイントは4レプリケートサンプルの平均を示します。エラーバーは平均からの標準偏差を示します。R2値は4-parameter curve fit処理で1.0です。この実験では、cGMPキャリブレーターのEC50値は2.2 nMでした。RFUは相対蛍光単位を示します。
Z´ factorは、キャリブレーター濃度ゼロとキャリブレーター濃度3333 nMの16反復を用いて決定しました。3つの蛍光マイクロプレートリーダーすべてで得られたZ´ factorの値の範囲は0.89から0.95の間でした。
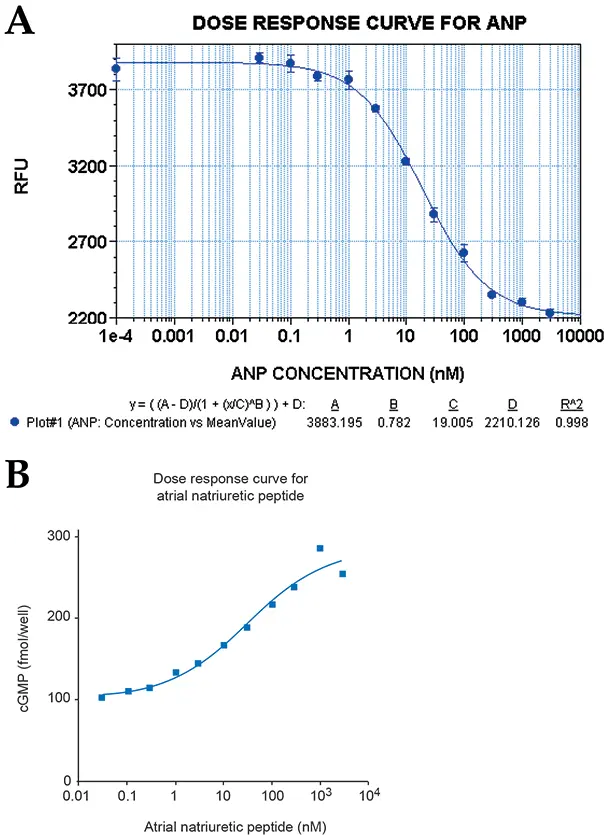
図2:ANP処理RFL-6細胞の用量反応曲線。用量反応曲線上の各ポイントは、活性化剤の1濃度に対する4レプリケートサンプルの平均を表します。データセットを読み取る前に、プレートをStoplight Red基質とともに60分間インキュベートしました。(A)の用量反応はGemini XSとSoftMax® Proを、(B)はGraphPad Prism®ソフトウェアを用いてAnalyst ADで得られたデータを示します。両方のインストゥルメンテーションで繰り返し実験して得られたEC50値は、11~19 nMでした。
ラット肺線維芽細胞株RFL-6を用いて、ペプチドホルモンANPによるGCの活性化を研究しました。図2に示すように、Gemini XSまたはAnalyst ADを用いた再現性実験から得られたEC50値は11~19 nMでした。SB比はGemini XSで400から450、Analystで300から350、FlexStationで425から500の範囲でした。Z´ factorsは、使用したすべての機器で0.5から0.73の範囲でした。
比色分析法との比較
次に、CatchPoint cGMP Fluorescent Assay Kitと他の市販の cGMP アッセイとの比較を行いました。CatchPoint アッセイを用いたキャリブレーター曲線の結果を、American Qualex社(カリフォルニア州サンクレメンテ)の試薬を用いた比色分析法と比較しました *11。比色分析法では、一次抗体、HRP-cGMPコンジュゲート(コンピテント)、cGMP含有サンプルを一晩インキュベートする必要があります。一方、CatchPointキットは2時間のインキュベーションで済みます。この2つのアッセイ法は、最適なインキュベーション時間で使用した場合、同じEC50値( \~250 fmol)を示します(図3参照)。
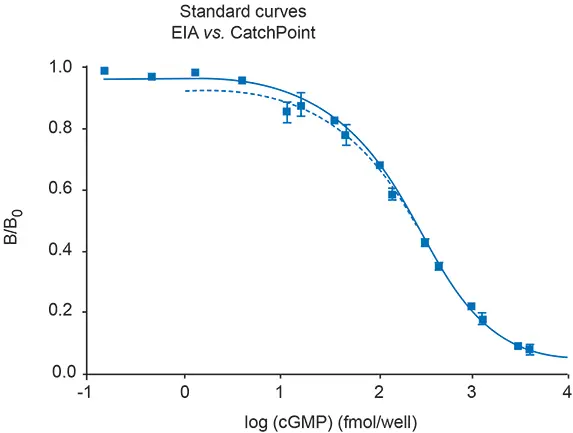
図3:各アッセイの最適培養時間で得られたEC50値の比較。比色分析(EIA、実線の四角)の完了時間は約18時間で、CatchPointアッセイ(破線)の時間は3時間でした。どちらのアッセイでも、キャリブレーターのEC50値はほぼ同じでした。
しかし、比色分析で2時間のインキュベーション時間を用いると、EC50値は著しく低下しました(表3参照)。さらに、CatchPointアッセイのシグナル対ノイズ比は比色分析アッセイの22倍でした。
| キットメーカー |
EC50値 |
シグナル対ノイズ比 |
|---|---|---|
| American Qualex | 948 | 4.9 |
| モレキュラーデバイス | 230 | 110 |
表3:比色分析(American Qualex)と蛍光(モレキュラーデバイス)のcGMPアッセイの比較。SN比は、3.7 nMキャリブレーターをシグナル、3333 nMキャリブレーターをノイズとして計算しました。
新規GC酵素を過剰発現したCOS-7細胞におけるサイクリックGMPレベル
サル腎臓細胞株COS-7を用いて、MsGC-β3と名付けられた新規GCの活性を研究しました。このGCは、NOに影響されない高い基礎活性を持ちます。MsGC-β3をCOS-7細胞に一過性にトランスフェクトし、72時間後、この酵素の2つの異なるトランスフェクタント、Mg2+とMn2+の存在下で、細胞のGC活性をアッセイしました。グアニル酸シクラーゼは、MnとMgの存在下で異なるレベルの活性を示すことが示されています *13。特異性では、他のあるNO非感受性GCは、Mg2+よりもMn2+の存在下で高い活性レベルを示しました(13)。その結果を図4に示します。
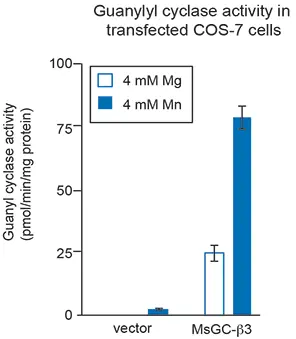
図4:GC過剰発現COS-7細胞におけるグアニリルシクラーゼ活性。細胞には、ベクター(ネガティブコントロール)または高い基底活性を持つGC変異体であるMsGC-β3をトランスフェクトしました。二価陽イオンのマグネシウムとマンガンは、MsGC-β3活性に必要な補因子です。
結論
本報告では、精製cGMP(キャリブレーター)およびcGMPを封じ込めた細胞溶解液を使用した場合、CatchPoint cGMPアッセイが高いSB比(直接比較で22:1)およびZ factor値を示す高感度アッセイであることを示しました。cGMPの測定には、2つの異なる細胞系を使用しました。まず、ペプチドホルモン誘導性cGMPレベルを測定し、次にユニークGCを一過性にトランスフェクトした細胞から産生されるcGMPレベルを測定しました。どちらのシステムでも、アッセイは信頼性が高く、高感度であることが実証されました。
CatchPointアッセイと比色分析アッセイを比較したところ、それぞれが最適な条件で使用された場合、2つのアッセイは非常によく似た結果を示しました。しかし、CatchPointアッセイの処理時間は3時間であったのに対し、比色分析では18時間を要しました。さらに、比色分析法には必須の終了ステップ(酢酸の添加)があり、シグナルは長時間安定しません。また、一定時間内に反応を終了させないと、コントロールを含むすべてのサンプルが飽和してしまい、値が無意味になってしまいます。対照的に、CatchPointアッセイで使用されるStoplight Red基質から生成されるシグナルは、24時間まで安定します。注目すべきは、一晩のインキュベーションではなく、2時間のインキュベーションで比色分析を比較した場合、キャリブレーターのEC50値は4倍以上増加したことです。これら2つの特徴、ワンステッププロセス不要と処理時間短縮は、ハイスループット研究室が必要とする利便性を提供します。
参考文献
- Wedel, B. and Garbers, D. 2001. The guanylyl cyclase family at Y2K. Annu. Rev. Physiol. 63: 215–233.
- Mateo, O. A. and de Artinano, A. A. 2000. Nitric oxide reactivity and mechanisms involved in its biological effects. Pharmacol. Res. 42: 421–427.
- Patel, M. J., Wypij, D. M., Dudley, A., Rimele, T. J. and Wiseman, J. S. 1995. Secretion of cyclic GMP by cultured epithelial and fibroblast cell lines in response to nitric oxide. J. Pharm. Exp. Therap. 273: 16–25.
- Dizhoor, A. M. and Hurley, J. B. 1999. Regulation of photoreceptor membrane guanylyl cyclases by guanylyl cyclase activator proteins. Methods 10: 521–531.
- Pugh, E. N., Duda, T., Sitaramayya, A. and Sharma, R. K. 1997. Photoreceptor guanylate cyclases: a review. Biosci. Rep. 17: 429–473.
- Vesely, D. L. 2002. Atrial natriuretic peptide prohormone gene expression: hormones and diseases that upregulate its expression. IUBMB Life 53: 153– 159.
- Azizo, V. A. and Muradova, S. R. 2001. Atrial natriuretic peptide and cardiovascular system. Anadolu Kardiyol. Derg. 2001. 1: 297–300.
- Morton, D. B. 1996. Neuropeptide-stimulated cyclic guanosine monophosphate immunoreactivity in the neurosecretory terminals of a neurohemal organ. J. Neurobiol. 29: 341–353.
- Nighorn, A. Byrnes, K. A., and Morton, D. B. 1999. Identification and characterization of a novel subunit of soluble guanylyl cyclase that is active in the absence of a second subunit and is relatively insensitive to nitric oxide. J. Biol. Chem. 274: 2525–2531.
- Morton, D. B. and Hudson, M. L. 2002. Cyclic GMP regulation and function in insects. Advances in Insect Physiol. In press.
- Kingan, T. G., Gray, W. Zitnan, D. and Adams, M. E. 1997. Regulation of ecdysis-triggering hormone release by eclosion hormone. J. Exp. Biol. 200: 3245–3256.
- Tremblay, J., Gerzer, R. and Hamlet, P. 1988. Cyclic GMP in cell function. Adv. Second Messenger Phosphoprotein Res. 22: 319–383.
- Simpson, P. J., Nighorn, A. and Morton, D. B. 1999. Identification of a novel guanylyl cyclase that is related to receptor guanylyl cyclases, but lacks extracellular and transmembrane domains. J. Biol. Chem. 274: 4440–4466.
CatchPoint cGMP Fluorescent Assay Kitについて >>
PDF版(英語)