Application Note 中枢神経系創薬における
幹細胞由来ヒトニューロン
PDF版(英語)
By L. Jackson, C. Verastegui, C. Wells, D. Pau, A. Nunn, A. Finucane, M. Lynch, S. Boldt, L. Gerrard, and S. J. MacKenzie, Scottish Biomedical, West of Scotland Science Park, Glasgow, Scotland, UK

はじめに
中枢神経系(CNS)疾患は世界中で多くの人々に影響を与えています。アルツハイマー病、統合失調症、不安障害などのCNS疾患治療に利用できる薬の質と数を増やすためには、CNS創薬プログラムの成功率を改善する必要があります。創薬における課題は、リード化合物を特定するために、より関連性の高いアッセイシステムを開発することです。現在CNS創薬と開発に使用されている細胞ベースのスクリーニングアッセイは、初代細胞または市販の細胞株を利用していますが、どちらにも多くの欠点があります。
材料と方法
分化プロセス
- 未分化幹細胞は、BD Biosciences製のMatrigel™ 基底膜マトリックスでコーティングされたIVFディッシュ上に、ヒト胚性幹細胞(hESC)コロニーを機械的に継代して播種しました。細胞はGerrard et al.(2005)に従ってヒトニューロンに分化させました。
免疫細胞化学
- 細胞を固定し、免疫細胞化学はGerrardら(2005)に従って実施しました。一次抗体はマウス抗Oct4(C-10; Santa Cruz)およびウサギ抗Pax6(Chemicon)を使用しました。二次抗体はヤギ抗マウスIgG Alexa Fluor 488およびヤギ抗ウサギIgG Alexa Fluor 555(Life Technologies, Inc.)を使用しました。画像はZeiss Axiovert 100M共焦点顕微鏡で63倍油浸レンズを用いて取得しました。
ウェスタンブロット解析
- 細胞溶解液を調製し、約30 μgの総タンパク質をNuPage® Novex 4–12% BisTrisゲル(Life Technologies, Inc.)で分離しました。ニトロセルロース膜に転写後、ウサギ抗GAD65/67抗体(Chemicon)でプローブしました。二次抗体はヤギ抗ウサギHPRT抗体(Sigma)を使用し、シグナルはECL検出基質(Pierce)で検出しました。
電気生理学
- (ホールセルパッチクランプ法を用いて、室温でイオン電流と活動電位を記録しました。細胞外液はNaCl(140 mM)、KCl(20 mM)、CaCl₂(2 mM)、MgCl₂(1 mM)、グルコース(10 mM)、HEPES(10 mM)、pH 7.4を含みました。細胞内ピペット溶液はKCl(30 mM)、HEPES(5 mM)、MgCl₂(1 mM)、K-アスパラテート(110 mM)、Na₂ATP(4 mM)、NaGTP(0.4 mM)、EGTA(0.015 mM)、pH 7.3を含みました。電流の電圧依存性は-90 mVの保持電位から測定し、ナトリウム電流を不活性化するために-40 mVから開始しました。100 msのパルスを1 Hzで+80 mVまで5 mV刻みで増加させました。薬物(例:GABA)の時間依存効果は、保持電位を-90 mVに固定して測定しました。カレントクランプ実験では、電流パルス列で細胞を反復刺激し、安定した再生性活動電位を誘発しました。
GPCR薬剤スクリーニングアッセイ開発
- Gタンパク質共役受容体(GPCR)活性化への応答は、FLIPR® Calcium 4 Assayの試薬を用いてFlexStation® 3 マルチモードマイクロプレートリーダーで測定しました。96ウェルフォーマットでは、細胞をポリ-D-リジンで予めコートした黒色ウェル・透明底の96ウェルBioCoatプレート(BD Biosciences)に播種し、アッセイの24時間前に100 μLの培養液で維持しました。FLIPR Calcium 4 Assayの試薬100 μL(5 mMプロベネシド、0.1% BSA含有)を各ウェルに添加し、37°Cで1時間インキュベートしました。10 μM LPA(50 μL)アゴニストをFlexStationプレートリーダーの「Flex」リードモードと統合ピペッターを使用して試験プレートに添加し、蛍光は励起485 nm、蛍光525 nmで測定しました。
結果
hESC由来ニューロンの生成
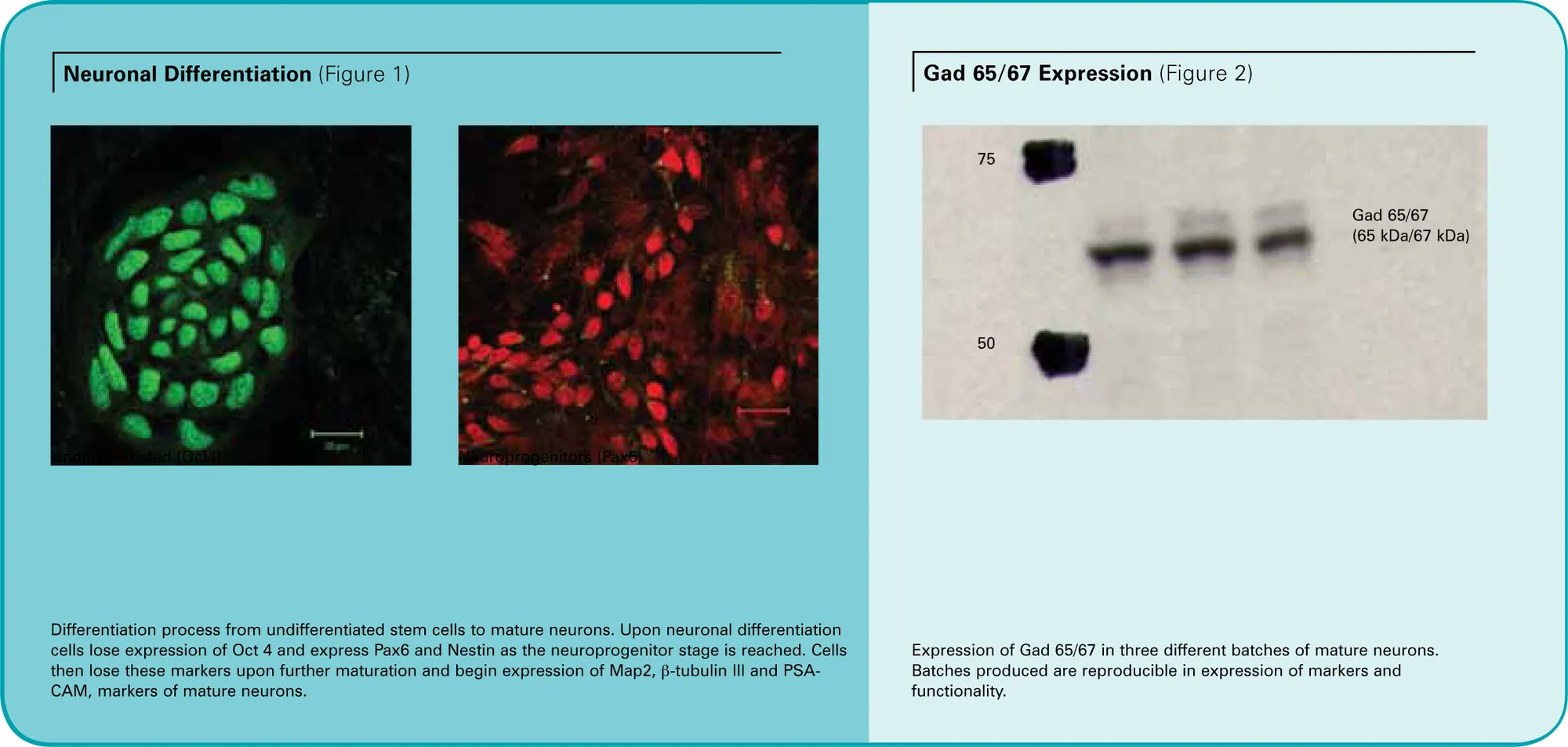
未分化hESCはNogginとbFGFを含むニューロン誘導培地に播種しました。細胞は約3週間培養され、その後ニューロン系譜への分化を開始しました。これは、ニューロン前駆細胞(NP)に関連するマーカーであるpax6とnestinの誘導から明らかです(図1)。さらに、bFGFを除去し、低細胞密度で播種することでニューロンの成熟が進みました。ニューロン細胞はMAP-2、β-チューブリンIII、PSA-NCAMの発現により同定されました。また、これらのニューロン細胞はGABA作動性表現型を示すGad65/67を発現することも確認されました(図2)。これらのニューロン細胞は、FlexStation® 3 マイクロプレートリーダーでの解析や電気生理学のために10 mmカバーガラスに播種されました。
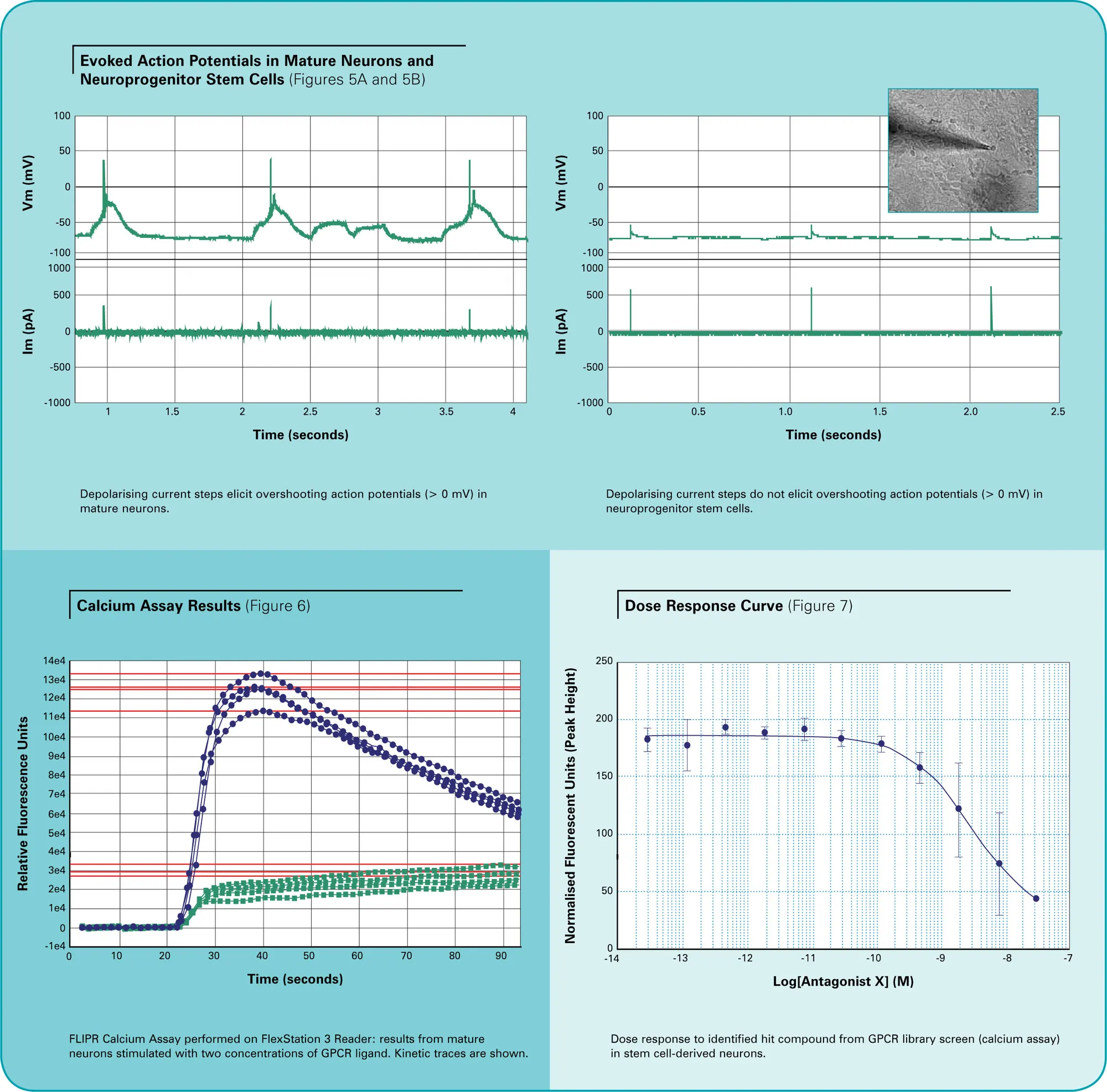
電気生理学
ホールセルパッチクランプ記録はニューロン前駆細胞と成熟ニューロンで行いました。両方の細胞タイプはカリウム外向き電流を示しましたが、成熟ニューロンのみがテトロドトキシン(TTX)100 nMに感受性のあるナトリウム内向き電流を示しました(図3A)。内向き電流は外向き電流と共存し、両方の電流は典型的な電圧依存性を示しました(図3B)。成熟ニューロンはグルタミン酸(100 μM)およびGABA(1 mM)の適用に応答して典型的なホールセル電流を発生し(図4A)、自発的な発火活動を示しました(図4B)。ニューロン前駆細胞ではこのような活動は観察されませんでした。カレントクランプ下で細胞を刺激し、活動電位を誘発しました。成熟ニューロンのほとんどはオーバーシュートする活動電位を発火できました(図5A)。これは、この細胞群にナトリウムチャネルが存在することと一致します。しかし、ニューロン前駆細胞では活動電位を生成または記録することはできませんでした(図5B)。

GPCRカルシウムアッセイ
本研究では、自然な内因性システムで候補ターゲットをスクリーニングするために使用できるカルシウム動員アッセイを示します。結果は、FLIPR Calcium 4 Assayで高品質なデータとアッセイ性能が得られ、他の類似アッセイシステムと同等であることを示しました。本研究では、GPCRターゲットを過剰発現するHEK細胞株と、同じターゲットを内因的に発現するニューロン(前述の方法で生成)を用いて、選択的拮抗薬でこのアッセイを検証しました(図6および図7)。過剰発現安定細胞株とGPCRターゲットを内因的に発現するニューロンの両方が、類似した阻害プロファイルと選択性を示しました。これは、ニューロン細胞株が自然な環境でGPCRターゲットをプロファイリングする優れたモデルであることを示しています。
ディスカッション
再現性のあるヒトニューロンバッチを生成できたことは、CNS創薬に大きな影響を与え、改善します。幹細胞由来ニューロンは成熟ニューロンに典型的に関連するすべての既知マーカーを発現し、機能的に活性です。これらの細胞は典型的なナトリウム(TTX感受性)およびカリウム電流を発現し、GABAおよびグルタミン酸の飽和濃度に応答します。さらに、これらの細胞はオーバーシュートする活動電位を発火する能力を持っています。
ニューロンをスクリーニング目的でフォーマットし、刺激時のカルシウムおよび膜電位応答を測定できます。ニューロンに内因的に発現するトランスポーターおよび受容体の発現プロファイルを確認し、目的のタンパク質を過剰発現させることも可能です。これにより、複数のCNS関連ターゲットに基づく優れたスクリーニングシステムをさらに強化できます。
最近のスクリーニングでは、統合失調症に関与する新規GPCRターゲットの拮抗薬を特定するためにこれらのニューロンを使用しました。ニューロンはこのGPCRを高レベルで発現し、比較研究のためにGPCRを過剰発現する安定細胞株を生成しました。カルシウム応答を測定することで、集中ライブラリスクリーニングからヒット化合物を特定しました。ニューロンは安定細胞株よりも多くのデータを提供し、プロジェクトの成功に必要な情報であることが証明されました。
参考文献
- Gerrard, L., Rodgers, L. and Cui, W. (2005). Differentiation of human embryonic stem cells into neural lineages in adherent culture by blocking BMP signalling. Stem Cells, 23: 1234–41.
FlexStation 3 マルチモードマイクロプレートリーダーについてさらに詳しく>>
PDF版(英語)