Application Note SpectraMax iD5プレートリーダーで
BCAベースのタンパク質定量を効率化
- 5分間の室温インキュベーションでタンパク質を迅速に定量
- SpectraMax iD5プレートリーダーで、バックグラウンドノイズを最小限に抑えながらアッセイ吸光度値を迅速に測定
- SoftMax Proソフトウェアの設定済みプロトコルを使用して、標準曲線をグラフ化し、サンプルタンパク質濃度を簡単に計算
PDF版(英語)
はじめに
Carole Crittenden | Applications Scientist | モレキュラーデバイス
Cathy Olsen, PhD | Sr. Applications Scientist | モレキュラーデバイス
Marissa Statner | Intern | モレキュラーデバイス
BCAアッセイは、サンプル中の総タンパク質を定量するために使用される2段階の比色アッセイ。このアッセイはビウレット反応を利用し、Cu2+がアルカリ性媒体中でタンパク質によってCu1+に還元されます。アミノ酸骨格は銅分子とカラーキレート錯体を形成し、銅カチオンを高感度かつ選択的に検出することができます。得られた水溶性複合体は強い吸光度を示し、マイクロプレートリーダーで測定することができます。オリジナルのPierce™ BCA Protein Assay Kitは、37℃で30分間インキュベートする必要があり、562nmで測定される色の変化を生じます。このアッセイの新しいバージョンであるPierce Rapid Gold BCA Protein Assay Kitは、室温で5分間インキュベートするだけで、480 nmで測定される強いオレンジゴールド色が得られます。
SpectraMax® iD5マルチモードマイクロプレートリーダーには、タンパク質定量アッセイに最適な吸光度検出モードが搭載されています。ここでは、SpectraMax iD5 プレートリーダーと SoftMax® Pro ソフトウェアを組み合わせて、Pierce BCA Protein Assay Kit と Pierce Rapid Gold BCA Protein Assay Kit の 2 種類のキットを用いて細胞タンパクサンプルを定量する方法をご説明します。このキットにはウシ血清アルブミンが含まれており、標準曲線の設定に使用されます。この標準曲線からサンプルの濃度が補間され、SoftMax Proソフトウェアの事前設定されたプロトコルによって自動的にレポートされます。Rapid Gold BCAアッセイに使用される室温での5分間のインキュベーションは、オリジナルキットに必要な37℃での30分間のインキュベーションと比較して、時間の節約と利便性をご提供します。
材料
- SpectraMax iD5 マルチモードマイクロプレートリーダー(モレキュラーデバイス)
- Pierce BCA Protein Assay Kit(ThermoFisher Scientific)
- Pierce Rapid Gold BCA Protein Assay Kit(ThermoFisher Scientific)
- RIPA Buffer(ThermoFisher Scientific)
- Halt Protease Inhibitor Single-Use Cocktail(ThermoFisher Scientific)
- 96ウェル、透明、平底ポリスチレンマイクロプレート(Greiner Bio-One)
- 293[HEK-293]細胞 (ATCC)
方法
HEK-293細胞をT75培養フラスコでサブコンフルエントになるまで培養。その後、カルシウムとマグネシウムを含む冷リン酸緩衝生理食塩水(PBS)10 mLで細胞を洗浄しました。冷RIPAバッファー2mLをフラスコに加え、細胞上に5分間放置した後、溶解した細胞を数回上下にピペッティングし、フラスコ表面から残存する細胞物質を遊離。溶解液を2本の1.5mL微量遠心チューブに分け、Halt Protease Inhibitorを加えました。溶解液を15,000rpmで20分間遠心し、上清を用いて未知サンプルをPBSで3倍希釈。希釈系列は、いくつかのサンプル希釈がアッセイの測定可能範囲内に収まるように実施しました。
BSA標準曲線は、各キットのユーザーガイドに記載されている方法に従って作成。各 BCA 作業試薬 12 mL を試薬 A と試薬 B の 50:1 の割合で調製し、25 µL のタンパク質標準品または細胞検体を透明な 96 ウェルマイクロプレートに 3 回に分けて移しました(アッセイごとに 1 セット)。一方のプレートには200μLのBCA作業試薬を、もう一方のプレートには200μLのRapid Gold BCA作業試薬を移しました。BCAアッセイプレートは37℃で30分間インキュベートし、BCA Rapid Goldアッセイプレートは室温で5分間インキュベート。
SpectraMax iD5 プレートリーダーで、あらかじめ設定した BCA アッセイ プロトコルを用いて吸光度を読み取った(SpectraMax iD3 プレートリーダーも SpectraMax iD5 プレートリーダーと同等の吸光度性能を持つため、これらのアッセイに適している)。BCAアッセイプレートは、プロトコルの元の波長設定である562 nmで読み取ったが、BCA Rapid Goldアッセイでは、プレートを読み取る前に波長設定を480 nmに変更した。
BSA標準曲線はSoftMax Proソフトウェアで作成し、アッセイキットのユーザーガイドで推奨されている二次曲線フィットを適用しました。各アッセイの標準曲線は、HEK-293 細胞サンプルの濃度算出に使用した。各キットのワークフローは図1をご参照ください。
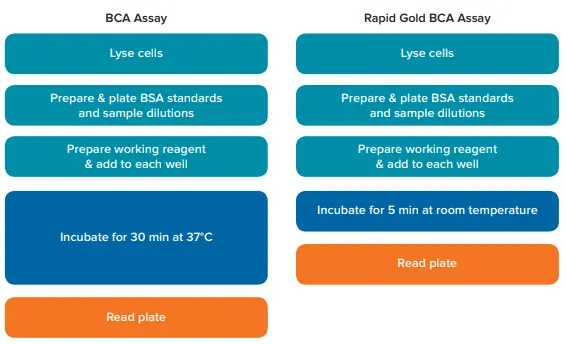
図1. アッセイワークフローの比較。BCAアッセイとRapid Gold BCAアッセイの実験手順を示します。BCAアッセイでは37℃で30分間のインキュベーションが必要であるのに対し、Rapid Gold BCAアッセイでは室温で5分間のインキュベーションで済みます。
結果
BCAアッセイとRapid Gold BCAアッセイのBSA標準曲線は、二次曲線フィットを用いてどちらも0.99を超えるr²値を示しました(図2)。BSA標準値の低いものから高いものまでのOD値の範囲は、BCAアッセイよりもBCA Rapid Goldアッセイの方が大きかったです。
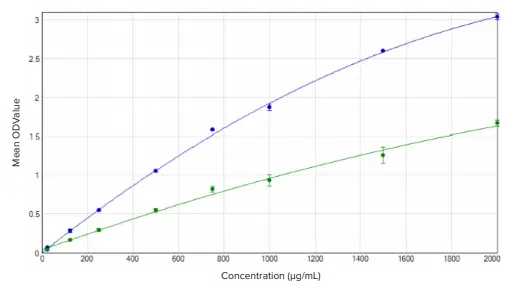
図2. BSA標準曲線。標準曲線は、BCA(緑)およびBCA Rapid Gold(青)アッセイについて、SoftMax Proソフトウェアの二次曲線フィットを用いてプロット。BCAではr² = 0.997、BCA Rapid Goldではr² = 0.999。各曲線について、n=3。
細胞溶解物濃度は標準曲線から補間し、SoftMax Proソフトウェアで自動的に計算し、グループ表に表示(BCA Rapid Goldグループ表を表1に示す)。BCA Rapid Goldアッセイでは、元の細胞溶解液サンプル濃度が680 µg/mLであったのに対し、BCAアッセイでは約640 µg/mLであったため、2つの標準曲線間で観察されたOD範囲の違いにもかかわらず、同様の濃度が算出されました。
| サンプル | ウェル | OD_Values | R | 濃度 | MeanConc | SD | Dilution | AdjConc |
|---|---|---|---|---|---|---|---|---|
| 01 |
B4 B5 B6 |
0.838 1.166 0.698 |
386 554 317 |
419 | 121.8 | 1.0 | 419 | |
| 02 |
C4 C5 C6 |
0.486 0.529 0.388 |
217 237 172 |
209 | 33.4 | 3.0 | 626 | |
| 03 |
D4 D5 D6 |
0.192 0.179 0.151 |
84 78 66 |
76 | 9.4 | 9.0 | 684 | |
| 04 |
E4 E5 E6 |
0.056 0.066 0.051 |
R R |
24 29 22 |
25 | 3.4 | 27.0 | 679 |
表1. BCA Rapid Goldアッセイのグループ表の例。測定した各OD値について、標準曲線から濃度を補間。標準曲線から外れた OD 値には「R」のフラグを付けました。各平均濃度について、平均濃度にサンプルの希釈倍率を乗じて調整濃度を算出。サンプル02、03、04は一貫した調整濃度を示したため、元のサンプルの濃度は680 µg/mLと推定されました。
結論
BCA Rapid Goldアッセイは、マイクロプレートを37℃で30分間インキュベートする必要があるオリジナルのBCAアッセイと比較して、マイクロプレートを室温で合計5分間インキュベートすることができます。どちらのアッセイでも、優れたr²値を持つ標準曲線が得られ、算出されたサンプル濃度もほぼ同じでした。
SpectraMax iD5プレートリーダーは、SoftMax Proソフトウェアの設定済みプロトコルを使用して、標準曲線のプロットやサンプル濃度の算出に使用する吸光度測定を迅速に実行します。プロトコールには、プレートを読み取るための設定や、標準曲線からのサンプル濃度の計算を含む分析をユーザーが簡単に設定できるテンプレートグループが含まれています。
PDF版(英語)