2021/9/4
SARS-CoV-2治療用モノクローナル抗体の迅速作製
モレキュラーデバイスのソリューションにより、科学者はFDA承認プロセスを迅速に進め、モノクローナル抗体の発見を加速することができます。
ウイルス粒子に対する臨床的に有効な中和抗体をベンチから患者まで同定・開発する期間は、通常18~24ヶ月です。SARS-CoV-2ウイルスのスパイク・タンパク質に対する有効な中和抗体を同定するための世界的な競争は、COVID-19パンデミックの最初の年に世界的な死者数が増加したため、死活問題となりました。
モレキュラーデバイスのクローンスクリーニングとCloneSelect™ Single-Cell Printer™およびCloneSelect Imagerを組み合わせることで、有効な中和抗体の前臨床開発期間を大幅に短縮することができます。事実、製薬界がSARS-CoV-2モノクローナル抗体を作成し、展開することができたスピードは、細胞株開発の自動化のパワーと可能性を物語っています。
この記事では、クローン選択から細胞増殖の追跡、画像ベースのモノクローナル性の保証まで、モレキュラーデバイスの機器を用いたモノクローナル抗体開発のステップを示します。その後、画像ベースのモノクローナル性レポートが作成され、米国食品医薬品局(FDA)への生物製剤承認申請(BLA)のようなグローバルなライセンス申請書に記載されます。
回復期血漿療法の代替としてのモノクローナル抗体
中和抗体はSARS-CoV-2に対抗する最も効果的な方法の一つとして登場しました。中和抗体は、ウイルス上のスパイクタンパク質やACE2宿主レセプターに結合することで、ウイルスが細胞内に侵入するのを防ぎます。回復期血漿療法により、回復した患者の血液細胞から分離された中和抗体は、ウイルス量を減少させ、症状の重い患者の死亡率を低下させるために使用されます[1][2][3]。しかし、この治療には中和抗体の血中濃度が高いドナーが必要であり、適切なドナーを見つけることは困難です [4]。
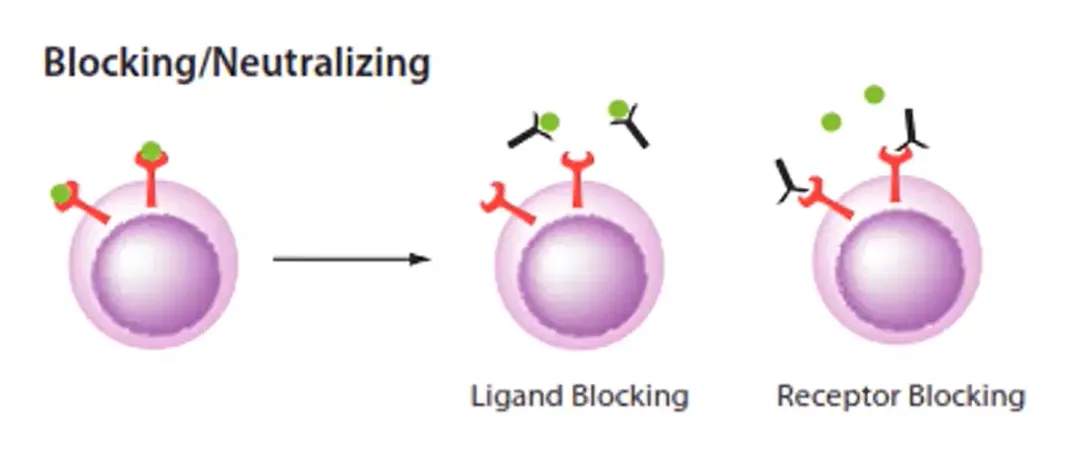
図1-中和抗体はスパイクタンパク質と結合することで、ウイルスが細胞に侵入するのを防ぎます。
最近では、SARS-CoV-2ウイルスの治療に、白血球からクローン化されたモノクローナル抗体(実験室で作られた抗体)が使用できるようになりました。モノクローナルという言葉は、単一の前駆細胞(単一細胞)に由来する細胞株を表し、規制当局への申請にはクローン性の証拠を文書化することが必要。予備的な結果では、これらの抗体は少なくとも5~7ヵ月間免疫学的なサポートを提供することが示されました[5]。治療の可能性を考えると、モノクローナル抗体の迅速かつ効率的な生産はますます重要になってきています。
モノクローナル抗体には、発見から概念実証試験までの時間という問題があります。抗体の同定からINDフェーズI試験までのタイムラインは、10-12ヶ月かかることもあります[6]。しかし、迅速かつ効率的なトランスフェクション、選択、クローンスクリーニングにより、プロセスを加速し、生産期間を半分に短縮する方法があります。
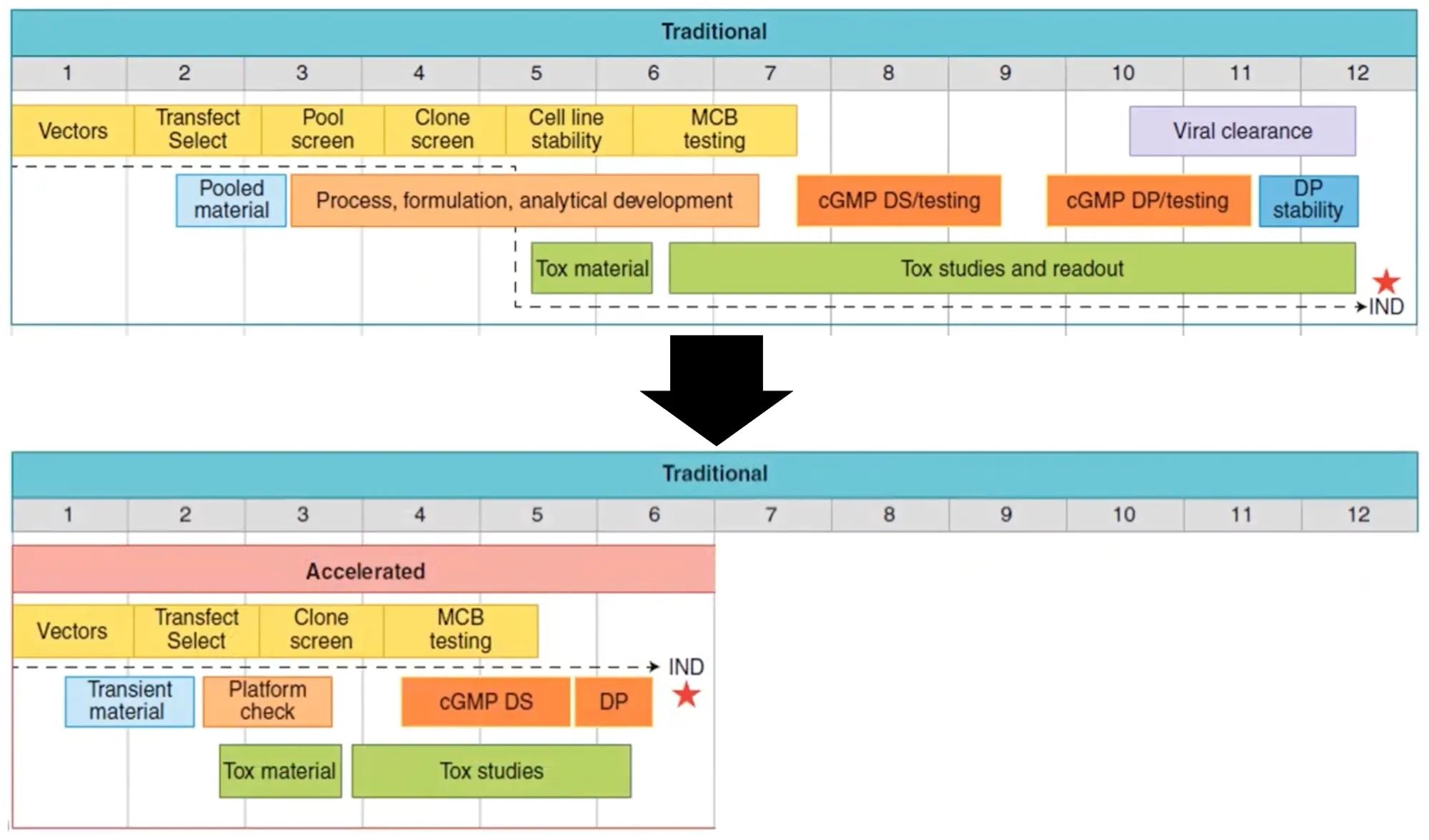
図2-発見から概念実証試験までの期間は、従来の10~12カ月から5~6カ月に短縮できます。
モノクローナル抗体開発の加速ワークフロー
細胞株開発に関する規制がますます厳しくなるにつれ、研究者は単一細胞クローニングを実施し、細胞株が単一細胞由来であることの証拠-クローン性の証明-を提出することが求められるようになります。従来のクローニング法(例えば、限界希釈法や FACS法)では、単クローン性の信頼レベルを決定するために統計的分析を用いています。しかし、モノクローナリティーの文書化は、バイオプロセスにおいてより強固な技術と方法論の必要性を促しています。多くの研究者は現在、CloneSelect Imager などのイメージングシステムを日常的に使用して、単クローン性を検証し、細胞培養培地中の細胞増殖をモニターしています。
許容可能な単クローン性保証を生み出す理想的な生産ワークフローは、以下のステップで構成されます。
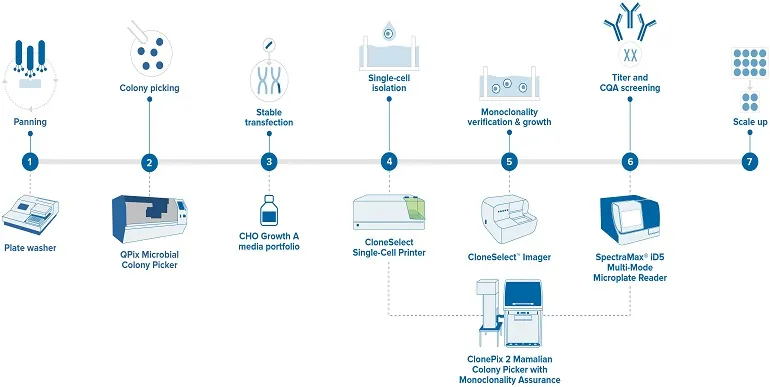
図3 - モノクローナル抗体開発のワークフロー
課題1:単一細胞の分離
強固なモノクローナル抗体産生の鍵は、個々の高性能細胞を単離することです。しかし、十分な数の標的細胞を得ることや細胞の生存率を維持することなど、単細胞分離には様々な課題があります。
限界希釈(LD)は伝統的な単離法で、親細胞培養を、確率計算に基づいてウェル内のプレート1枚につき細胞1個になるまで希釈を繰り返します。主な欠点は分離効率が低いことで、プレートあたりの細胞数がゼロと複数の細胞の間で変動することを意味します[7]。
フローサイトメトリー(FC)は、蛍光活性化細胞選別を実施する、より成功した分離方法ですが、高圧、電荷への暴露、頻繁な高速衝突のため、細胞の生存率が損なわれます。この生存不可能な条件は、ソーター誘発性細胞ストレス(SICS)と呼ばれるものにつながります[8]。そのため、繊細な細胞種を扱っている場合、フローサイトメトリーで得られた細胞株は、さらなる研究には適さず、タイムラインを数ヶ月遅らせることになるかもしれません。
マイクロ流体チップで単一細胞を分離するプロセスであるマイクロ流体工学は、従来の方法に代わるより効率的な方法として台頭してきています。マイクロフルイディクスを際立たせている要因のひとつは、マイクロリットル・チップにサンプルをロードするため、投入量が大幅に減少することです。マイクロチップは分注圧力が低いため、SICSリスクも減少。最後に、マイクロ流体工学はサンプル間のコンタミネーションのリスクを排除します[9]。
我々は最近、これら3つの方法のシングルセル効率を比較しました。マイクロ流体力学に基づく単離のデモンストレーションのために、私たちはCloneSelect Single-Cell Printerを使用しました。このプリンターは、このテクノロジーと高解像度イメージングを組み合わせ、単クローン性の画像ベースの証拠を記録しながら個々の細胞を単離するものです。下の棒グラフでおわかりのように、CloneSelect Single-Cell PrinterはLDとFCをそれぞれ8倍、10-20%上回りました。
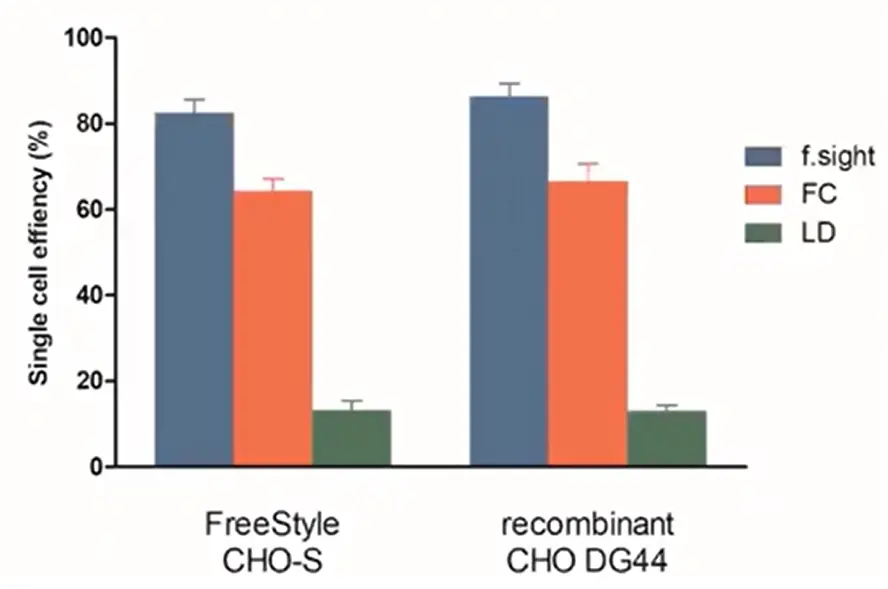
図4 - 単一セルの効率:f-サイトはLDやFCよりも優れためっき効率を持っています。
課題2:コロニーの増殖効率
次の問題は、モノクローナル・コロニーを作製しようとする場合、単一細胞の効率はどのように反映されるのか、ということです。
マイクロフルイディクスとLDおよびFCのコロニー成長比較のために、私たちは単一細胞から90秒間分裂をスキャンできるCloneSelect Imagerを使用しました。CloneSelect Imagerは、チャート統計と細胞成長の視覚的サムネイルの両方を証拠として提供。CSIでは、その後14日間プレートをスキャンできるので、最終画像からゼロ日目まで簡単にさかのぼり、コロニーが本当に単一細胞から形成されたことを証明することができます。さらに、コロニー画像をPDFまたはWordのレポートとしてエクスポートし、画像ベースの単一性保証を行うことができます。
では、これがタイムラインの短縮にどのように貢献するのでしょうか?確率ベースと画像ベースの保証を提供するために2ラウンドの単離を行う代わりに、1ラウンドのクローニングのために単細胞プリンターとイメージャーを相乗的に使用することができます。この方法は、99.99%以上の信頼性で単クローン性を保証することが証明されています[10]。
フリースタイルと組換えCHO細胞の両方について、成長効率の結果を以下に示します。
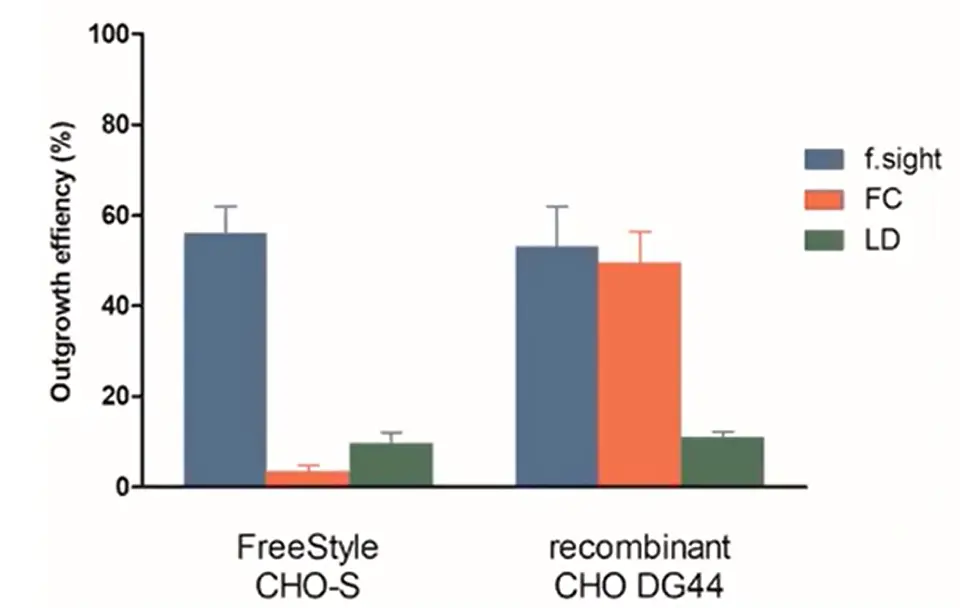
図5-コロニーアウトグロースの効率:f.sightは、従来の限界希釈と比較して、クローンアウトグロースが5倍以上改善されていることを示しています。
シングルセルの効率と同様、LDはどちらの細胞株でも芳しくなかったです。興味深いことに、FCは組換え細胞ではCloneSelect Single-Cell Printerとほぼ同等の効率を示しましたが、フリースタイルの細胞では15倍も悪かったです。このことは、CloneSelect Imager テクノロジーと組み合わせた CloneSelect Single-Cell Printer™ の方が、FC よりもコロニー形成が安定していることを明確に示しています。
課題3:大規模な単クローン性と分泌
単クローン性だけでなく、抗体の十分な分泌についても何十万ものクローンをスクリーニングする必要があるため、候補となる哺乳類細胞クローンの単離には多大な労力と時間がかかります。
モレキュラーデバイスは、単クローン性を証明するエンドツーエンドの自動細胞株開発ワークフローのためにClonePix®システムを開発しました。ClonePixシステムは、多数のCHOクローンから分泌される中和抗体をin situでスクリーニングし、定量する機能を備えています。ソフトウェアは蛍光検出プローブを用いて分泌量を定量し、収率の高いクローンを自動的に選び出します。
以下に示すように、ClonePixはいくつかの点でLDを凌駕しています。より少ないプレート枚数で大幅に多くのコロニーをスクリーニングできるだけでなく、収率の高いコロニーを選ぶことができます。
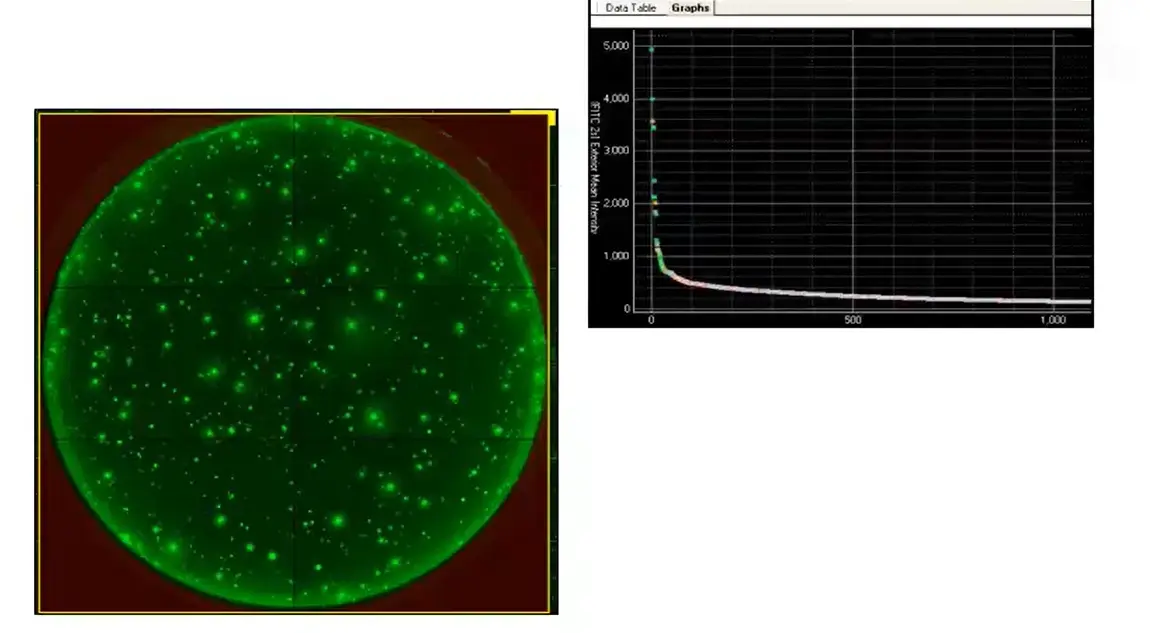
図6-ClonePix:in situでは、生産性を決定するために、単一時点ではなく、累積日付を使用できます。
タイムラインの短縮についてはどうですか?ClonePix2 自動動物細胞コロニーピッキングシステムワークフローのオリジナルバージョンは、CloneSelect Single-Cell Printerとイメージングの組み合わせで、FDAが提案するように2ラウンドのスクリーニングを必要とします。
ラボの自動化対応ワークフローを探る
お客様のアイデアを実現しましょう!当社のカスタマイズ・自動化チームは、ソフトウェアやハードウェアを含め、お客様のご要望に応じてClonePix 2 自動動物細胞コロニーピッキングシステムのカスタマイズに成功しています。例えば、モノクローナル保証機能を追加してシステムを更新することにより、1台の装置で抗体スクリーニングから力価測定までのすべてのモノクローナル抗体作製ワークフローのニーズに1回のクローンスクリーニングで対応することができます。
モレキュラーデバイスの自動化されたクローンスクリーニングワークフローを使用することで、複数のプロセスから取得したデータの一元的なリポジトリを作成しながら、作業時間を大幅に削減し、ラボの負担を軽減することができます。モレキュラーデバイスの自動化されたソリューションは、ラボのすべての装置を統合し、人的作業を減らしながらスループットと効率を向上させます。
参考文献
- Mair-Jenkins, John, et al. "The effectiveness of convalescent plasma and hyperimmune immunoglobulin for the treatment of severe acute respiratory infections of viral etiology: a systematic review and exploratory meta-analysis." The Journal of infectious diseases 211.1 (2015): 80-90.Mair-Jenkins, John, et al. "The effectiveness of convalescent plasma and hyperimmune immunoglobulin for the treatment of severe acute respiratory infections of viral etiology: a systematic review and exploratory meta-analysis." The Journal of infectious diseases 211.1 (2015): 80-90.
- Ko, Jae-Hoon, et al. "Challenges of convalescent plasma infusion therapy in Middle East respiratory coronavirus infection: a single centre experience." Antivir ther 23.7 (2018): 617-622.Ko, Jae-Hoon, et al. "Challenges of convalescent plasma infusion therapy in Middle East respiratory coronavirus infection: a single centre experience." Antivir ther 23.7 (2018): 617-622.
- Shen, Chenguang, et al. "Treatment of 5 critically ill patients with COVID-19 with convalescent plasma." Jama 323.16 (2020): 1582-1589.Shen, Chenguang, et al. "Treatment of 5 critically ill patients with COVID-19 with convalescent plasma." Jama 323.16 (2020): 1582-1589.
- Gontu, Abhinay, et al. "Limited window for donation of convalescent plasma with high live-virus neutralizing antibody titers for COVID-19 immunotherapy." Communications biology 4.1 (2021): 1-9.Gontu, Abhinay, et al. "Limited window for donation of convalescent plasma with high live-virus neutralizing antibody titers for COVID-19 immunotherapy." Communications biology 4.1 (2021): 1-9.
- Ripperger, Tyler J., et al. "Orthogonal SARS-CoV-2 serological assays enable surveillance of low-prevalence communities and reveal durable humoral immunity." Immunity 53.5 (2020): 925-933.Ripperger, Tyler J., et al. "Orthogonal SARS-CoV-2 serological assays enable surveillance of low-prevalence communities and reveal durable humoral immunity." Immunity 53.5 (2020): 925-933.
- Kelley, Brian. "Developing therapeutic monoclonal antibodies at pandemic pace." Nature Biotechnology 38.5 (2020): 540-545.Kelley, Brian. "Developing therapeutic monoclonal antibodies at pandemic pace." Nature Biotechnology 38.5 (2020): 540-545.
- Heisler, E., and H. W. Vohr. "3D Human Skin/Epidermal Models and Organotypic Human and Murine Skin Explant Systems. The Encyclopedic Reference of Immunotoxicology." (2005).Heisler, E., and H. W. Vohr. "3D Human Skin/Epidermal Models and Organotypic Human and Murine Skin Explant Systems. The Encyclopedic Reference of Immunotoxicology." (2005).
- Hu, Ping, et al. "Single cell isolation and analysis." Frontiers in cell and developmental biology 4 (2016): 116.Hu, Ping, et al. "Single cell isolation and analysis." Frontiers in cell and developmental biology 4 (2016): 116.
- Gross, Andre, et al. "Technologies for single-cell isolation." International journal of molecular sciences 16.8 (2015): 16897-16919.Gross, Andre, et al. "Technologies for single-cell isolation." International journal of molecular sciences 16.8 (2015): 16897-16919.
- Yim, Mandy, and David Shaw. "Achieving greater efficiency and higher confidence in single‐cell cloning by combining cell printing and plate imaging technologies." Biotechnology progress 34.6 (2018): 1454-1459.Yim, Mandy, and David Shaw. "Achieving greater efficiency and higher confidence in single‐cell cloning by combining cell printing and plate imaging technologies." Biotechnology progress 34.6 (2018): 1454-1459.