2023/3/7
3D細胞モデルが創薬の未来をどう形成するか
ターゲット探索と薬剤開発は、薬剤候補の有効性と毒性効果を読み解くために、2次元細胞モデルと動物モデルに大きく依存している。しかし、候補化合物の90%は第III相臨床試験を通過することができない(1)。これは多くの場合、前臨床モデルでは捉えきれなかった合併症が原因である。これらのモデルを改良することで、臨床失敗のリスクを回避し、医薬品開発プロジェクトの潜在的な遅延や終了を防ぐことができる。2D細胞モデルを自己組織化3Dモデルに置き換えることは、この目標に向けた一歩である。しかし、これは単純なプロセスではなく、利点と同じくらい多くの課題をもたらす。
Drug Target Reviewでは、3D細胞モデルの過去、現在、そして未来について、アストラゼネカのオンコロジー安全性科学部門アソシエイト・ディレクターであるケネス・プライド氏、HeartBeat.bioの最高技術責任者であるフロリアン・フックス氏、そしてモレキュラーデバイスの戦略・イノベーション担当副社長であるシャン・ダミジャ氏とともに議論しています。
この座談会では、業界をリードする専門家たちが、創薬を前進させるための3Dバイオロジーとオルガノイドの有望性について議論する。3Dバイオロジーの課題を克服する方法と、3Dオルガノイド研究の将来像を考察する。
医薬品開発において2次元細胞培養と動物モデルは理想的か?
動物モデルはヒトの生物学的研究や医薬品開発に広く用いられています。規制の観点と安全性の観点から、医薬分子は第1相臨床試験の前に前臨床動物試験を受ける必要がある。しかし、動物における薬物動態や薬力学の評価はヒトに比べて限定的であるため、前臨床試験での観察結果が必ずしも臨床成績に反映されるとは限らない。Pryde博士はin vitroモデルの必要性を強調する: "動物モデルでは特定できなかった、臨床での萎縮や安全性の問題が顕在化するリスクを減少させるために、動物モデルを補う追加のin vitroモデルが必要です"。
"動物モデルでは特定できなかった、臨床での萎縮や安全性の問題が顕在化するリスクを減少させるために、これらの動物モデルを補う追加のin vitroモデルが必要である"
2次元細胞モデルは動物実験を補い、前臨床評価の精度を向上させるが、複雑化する疾患モデルや標的創薬ではその限界が表面化する。従来の2D細胞モデルやそれに対応するアッセイでは、細胞間コミュニケーション、細胞外マトリックス(ECM)相互作用、物理的制約などの生理的事象を再現できない。ダミジャ氏によれば、新しい技術に注目するのは不釣り合いである: 「新しいツールは、生物学的な深さでの正確で微妙な発見を可能にしますが、モデル系を変えない限り、間違った答えを見つけるのがうまくなるだけです。」
「モデル系を変えない限り、間違った答えを見つけるのがうまくなるだけだ」
3D細胞モデルが2D細胞モデルより優れている理由は?
3D細胞モデルが際立っている主な理由の一つは、2D細胞モデルとは対照的に、生体内環境をよりよく表現できるため、化合物の潜在的な影響をより予測しやすいことである。これはまた、潜在的なリスクを前臨床的に予測できるため、毒性学的研究においてより優れたパフォーマンスを発揮するのに役立ちます。このような観点から、3D細胞モデルは、動物実験における偽陰性や偽陽性に関連するリスクを軽減する。
医薬品開発や試験において動物モデルは依然として不可欠であるため、3D細胞モデルはヒトの生理学との関連性を評価するためにも活用できる。様々な動物組織を代表するセルモデルは、免疫原性反応や機能変化に影響する動物とヒトの細胞動態の相関関係を解明するのに役立つ。種類のモデルを組み合わせることで、データの誤 解のリスクを最小限に抑えながら、研究対象の組織や臓器 をより全身的に見ることができる。
様々なタイプのモデルを組み合わせることで、データの誤解のリスクを最小限に抑えながら、研究対象の組織や臓器をより系統的に見ることができる。
3D細胞モデルの種類と利点
スフェロイド、3Dバイオプリントモデル、オルガノイド、Organ-on-a-chip。スフェロイドは、複数のセルが合体して球体を形成したものである。3Dバイオプリントモデルは、細胞に加えて空間的な複雑さや3D細胞外マトリックスを導入しているため、一歩進んでいる。オルガノイドは、幹細胞に由来する、自己組織化された小さな三次元組織培養物である。最後のカテゴリーはOrgan-on-a-chipで、循環、機械的ストレス要因、異なる組織間の相互作用の影響をシミュレートするためにマイクロ流体工学を導入している。
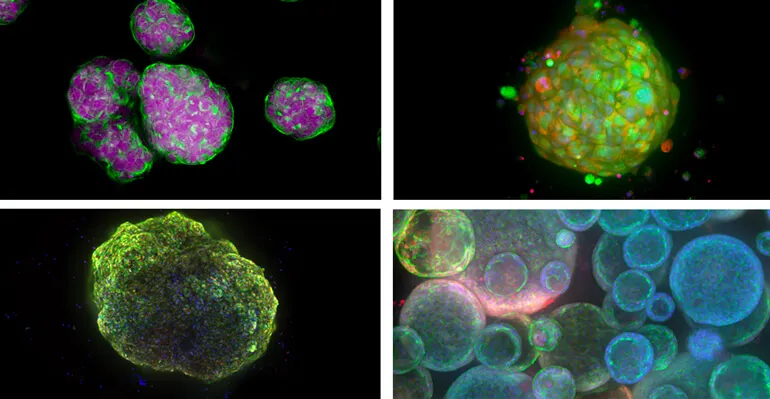
左上からスフェロイド、患者由来オルガノイド(または腫瘍)、心臓オルガノイド、肺オルガノイド。
3Dモデルにはそれぞれ長所と短所がある。しかし、オルガノイドは多くの理由で広く使われている。Fuchs博士が他の3Dモデルよりもオルガノイドを好む理由は、「オルガノイドには本質的に増幅能力があり、組織内のすべての発生段階をモデル化することができるから」である。しかし、免疫原性の要素がないなどの限界は認めている。Pryde博士が強調するオルガノイドとスフェロイドのもう一つのハイライトは、そのスケーラビリティとハイスループット能力である。そのため、有効性や毒性研究のためのハイスループット・ドラッグスクリーニングに定期的に使用することができる。
オルガノイドの主な利点の一つは、その汎用性である。膨大なツールのレパートリーを通じて、特異性を発揮するようにオルガノイドのデザインを微調整することができる。多能性幹細胞は、組織特異性細胞に直接分化できるため、オルガノイド研究における主要な供給源である。これは、より生物学的に適切であり、構成する細胞タイプや細胞外マトリックスを再現するのに適している。さらに、遺伝子改変が可能であることから、疾患メカニズム、薬物作用、薬剤耐性、毒性学などの研究において、より深い知見を得ることができる。

MIMETASのOrgan-on-a-chip技術、OrganoPlate®。
とはいえ、Organ-on-a-chipのような他のモデルは、スループットが低いにもかかわらず、より洗練されたシステムを再現することができる。その時点で、ハイスループットよりも複雑性の相対的重要性を決定し、特異性研究に最適なモデルを選択するのは研究者次第である。
オルガノイド研究の未来
生物学的に適切なオルガノイドの出現と、オルガノイドワークフローの技術的改良は、エキサイティングな研究の機会を生み出す。フックス博士は、胚発生を模倣するために人工胚を使用する可能性を強調し、これによりヒトの発生をより深く理解することができると述べた。また、動物を完全に使わない前臨床試験ルーチンに移行する必要性についても言及し、規制当局にその基準を再調整するよう求めている。「実際、動物モデルは生物製剤の試験には役に立たないかもしれません。例えば、ヒト化抗体のワクチンなどは、動物モデルでは免疫原性が弱いのです。ですから、治療法の影響を観察することができないとわかっていながら動物を使用するのは意味がありません。
「実際、動物モデルは生物製剤の試験には役立たないかもしれない。例えば、ヒト化抗体のワクチンなどは、動物モデルでは免疫原性が弱い。ですから、治療法の影響を観察することができないとわかっていながら動物を使用するのは意味がないのです。」
プライド博士は、オルガノイド研究が個別化医療に大きく貢献することを期待している。「3Dモデルは、潜在的な薬剤感受性や耐性を同定するために、患者から生物学的製剤にアクセスすることで、治療分野における新たな道を切り開きます。この分析結果は、臨床医に特定の薬剤が有益で患者に適しているかどうかを判断するための情報を提供することができます」。
ダミジャ氏によれば、機械学習は、特にモデル系をデリスク化する際に、3Dモデルに不可欠な要素になる可能性が高いという。「学術界では、複雑性を追求するインセンティブがありますが、ロバスト性のある3Dモデル研究プロトコルを確立することは、産業界にとっても同様に重要です。機械学習によって、新しいモデルは、より再現性、拡張性、一貫性を高めることができ、市場や患者への提供の大幅な遅れの原因となるデータの不一致のリスクを軽減することができます。"
機械学習を用いることで、新規モデルの再現性、拡張性、一貫性を高めることができ、市場や患者への提供に大幅な遅れをもたらすデータの不一致のリスクを軽減することができる。
とはいえ、オルガノイド研究の完成までには長い道のりがある。もちろん、大規模な患者サンプルへのアクセスや、十分な数の幹細胞ドナーを見つけることも課題の一つである。現在のところ、薬物スクリーニングや毒性学的研究は、患者のばらつきのために臨床研究への応用に失敗している。そのため、前臨床試験においてこのようなばらつきを考慮するために、患者由来の材料へのアクセスを拡大する必要がある。さらに、予測の信頼性を高めるために、研究者はin vitroモデルを計算モデルで補うことができる。
-
Mullard, Asher. "臨床成功率の解析" Nature Reviews Drug Discovery 15.7 (2016): 447-448.
* エンドツーエンド
私たちの研究の現場を覗いてみませんか!
オルガノイドイノベーションセンターでは、インテリジェントなラベルフリーイメージングにより、自律的、長期的、生細胞の2Dおよび3D細胞培養の成長とモニタリングのために調和して動作する最先端の機器を展示しています。この統合されたワークフローは、品質管理の警告と準備、3Dオルガノイドスクリーニング、他のテクノロジーが見逃している隠れたパターンを明らかにするディープラーニング画像解析を提供します。