2024/1/5
オルガノイドの専門家が語る
オルガノイド研究における3Dイメージングの複雑さと利点
ヒトの生物学は複雑で、多くの生物学的プロセスや疾患の背後にある複雑な仕組みは、完全には解明されていません。2Dモデルではこの複雑性を再現することができないため、表面的な部分しか知ることができません。薬剤の有効性と安全性を予測するロバスト性が欠如していることが、現在の薬剤候補の90%以上が臨床試験に失敗する理由の一つです (1)。3Dイメージングは、より適切で正確なモデルを提供することにより、これを改善する可能性を提供します。しかし、3Dイメージングは、最適な成功のために克服しなければならない独自の課題ももたらします。
Drug Target Reviewの新しいポッドキャストでは、Dr. Hilary Sherman(コーニング・ライフサイエンス社シニアアプリケーションサイエンティスト)とDr. Oksana Sirenko(モレキュラーデバイス アッセイ開発シニアマネージャー)が、3Dイメージング技術が複雑な細胞モデルの可視化と解析におけるギャップをどのように埋めることができるかについて議論しています。
HilaryとOksanaの両氏は、3D細胞モデルの開発と活用において豊富な経験を有しています。二人は、ヒトの生物学とその反応をエミュレートし予測する上でオルガノイドが持つ利点と、これらのサンプルの画像化と分析に伴う課題について議論します。
なぜ2Dではなく3Dなのでしょうか?
ヒトの組織、臓器、腫瘍は平坦な2D構造ではなく、多くの異なるタイプの細胞からなる複雑な3D集合体です。さらに、栄養や薬物の取り込み、pH勾配、シグナル伝達、老廃物処理、細胞間相互作用などの重要な生物学的プロセスは、すべて3D状況で起こります。これらの現象は、細胞生物学や薬物の作用機序に大きな影響を与える可能性があるが、従来の2D細胞モデルでは、このような複雑性をほとんど、あるいは全く捉えることができません。そのため、2Dではうまく機能する薬剤や治療法でも、in vivoで使用すると同じ効果が得られないことがあります。この2Dと3D環境の断絶は、研究室では有望と思われた薬剤の多くが臨床試験で失敗する理由の一部を説明しています。3Dシステムを構築することで、より生物学的製剤に近い細胞モデルを作成することができ、「実世界」での薬剤や治療法の効果をよりよく模倣することができます。
この2Dと3D環境の断絶は、研究室では有望と思われた多くの薬が臨床試験で失敗する理由の一部を説明しています。
他の3D細胞モデルに対するオルガノイドの利点
3Dオルガノイドには、一般的に使用されている他の3D細胞モデルにはない利点もあります。
オルガノイドがスフェロイドと異なるのは、より構造化され洗練されているからです。スフェロイドが1つか2つのタイプの細胞のクラスタからなるのに対し、オルガノイドは前駆細胞(幹細胞)に由来し、複数のタイプの細胞に分化して実際の臓器モデルを作ります。オルガノイド内の異なる細胞型の偏光は、極性や内腔(臓器の空洞のような中心部)という点で、体内の臓器をよりよく表しています。細胞間の相互作用や適切な方向性をよりよく示すために、科学者はしばしばオルガノイドを細胞外マトリックスやコラーゲンでカプセル化します。このように、オルガノイドはある組織や臓器の機能をシミュレートするのに最適です。
複雑なヒトの組織や臓器を表現する場合、オルガノイドとOrgan-on-a-chipは、最終的なゴールは似ているものの、異なるアプローチをとります。Organ-on-a-chipは、機能的かつ制御された設計のために、研究対象の臓器とその環境に関する広範な知識を必要とします。対照的に、オルガノイドは、幹細胞が本質的に自己組織化し、機能的な細胞タイプに分化する能力を持つため、より簡単に設計することができます。
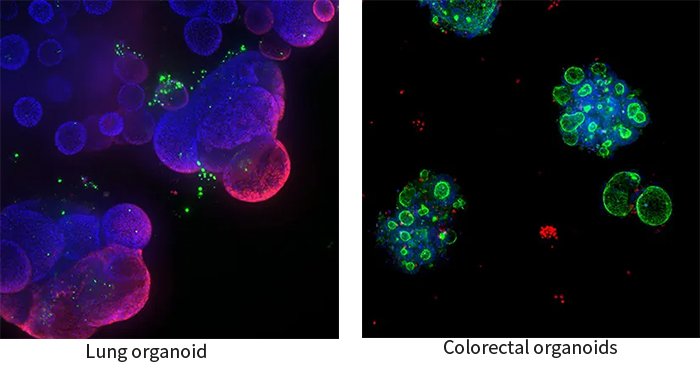
オルガノイドは個別化医療に使えるのでしょうか?
上述したオルガノイドの特徴から、オルガノイドは個別化医療の理想的な候補となります。トリプルネガティブ乳がんなどの多くのがんサブタイプはこのカテゴリーに属し、化学療法に対する反応は患者によってかなり異なります。患者の生検からオルガノイドを採取することで、科学者たちは患者由来オルガノイド(PDO)を作成することができます。これにより、特異性腫瘍に対する様々な化合物の効果を評価することができ、最終的には治療に対する患者の反応をより正確に予測することができます。
オルガノイドの複雑さ
Hilaryによれば、オルガノイド開発のワークフローは標準化されているものの、オルガノイドを扱う際には多くの要素を考慮しなければりません。「スフェロイドは2D細胞培養と同様にプレーティングを利用できるので、作業は簡単です。オルガノイドを扱うようになると、様々な培地処方や、成長因子などの高価な試薬が必要になるため、ワークフローはより複雑になります」。
スフェロイドは、2D細胞培養と同様にプレートを利用できるので、作業は簡単です。オルガノイドを扱うようになると、様々な培地の調合や成長因子などの高価な試薬が必要になるため、ワークフローはより複雑になります。
もう一つの要件は、細胞外マトリックス(ECM)としてコーニング®マトリゲル®マトリックスを採用することであり、これはオルガノイドの完全性や偏光を確立する役割を担っています。しかし、温度によって物理化学的特性が変動するため、取り扱いが難しい材料であり、リキッドハンドリングに問題があるだけでなく、3D構造をイメージングする際にさらなる最適化が必要となります。
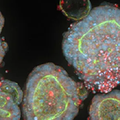
各オルガノイドのタイプは、ワークフローが多様であるため、独自の複雑さを抱えています。多くのワークフローは、人工多能性細胞(iPCS)を前駆細胞に分化させることから始まりますが、その後のステップは前駆細胞のタイプ(心臓、神経細胞、肝臓、腸など)によって異なることがあります。例えば、大脳(脳)オルガノイドでは、iPCSをマトリゲルマトリックス液滴に移す前に、神経誘導培地に移す必要があります。もう一つの例は腸/直腸オルガノイドのワークフローで、直腸オルガノイドをハイドロゲル内のGri3D®マイクロパターンU底型マイクロウェルで培養し、複雑さを増します。
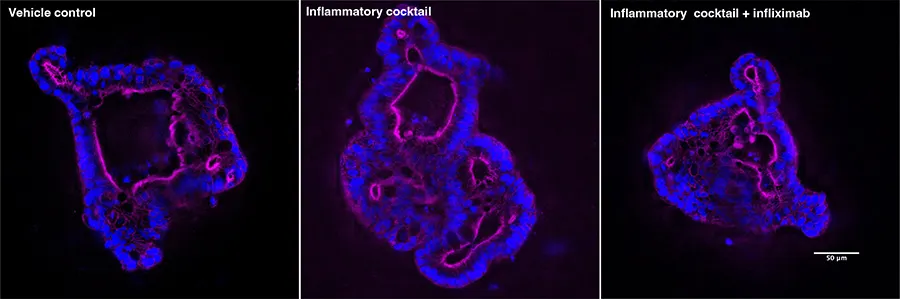
炎症性サイトカインに曝露したヒト直腸オルガノイドの高倍率共焦点像。F-アクチン(マゼンタ)とDAPI(青)の40倍単面像。
イメージングと画像解析における課題
3D細胞バイオロジーの複雑さに加えて、これらのモデルをイメージングする際にも課題が生じることがあります。染色試薬が構造体に浸透するのが難しくなり、十分な光の浸潤と適切な焦点の欠如が正確なイメージングに影響することがあります。
複雑な3Dオルガノイドを扱う場合、科学者は細胞モデルへの試薬の浸透を考慮する必要があります。そのため、透過化バッファー濃度を上げたり、インキュベーション時間を長くしたり、抗体濃度を上げたりするなどの配慮が必要になります。
Oksanaは、染色と固定の時間を長くすることの重要性を強調しています。
2D培養なら30分もあれば十分ですが、オルガノイドは染色液で少なくとも2時間は培養する必要があります。固定も少なくとも2時間、理想的には一晩行う必要があります
撮像モダリティはもう一つの重要な要素であり、オルガノイドを撮像する際には、焦点のずれた光と光の透過の両方が課題となりうります。しかし、付加的な機能によって画質を向上させることができます。例えば、水浸対物レンズは、対物レンズとサンプルの間に水層を設けることで、異なる倍率レベルでも画像の解像度と感度を向上させ、最終的にシャープな画像を得ることができます。
オルガノイドは厚いため、光源は画像の解像度を向上させ、光学収差を最小限に抑えるために十分な照度を必要とします。しかし、標準的なLED光では、所望の明るさを得るには長い画像取得時間が必要であり、その結果、画像強度が低下し、光脱落の可能性があります。ImageXpress® Confocal HT.aiハイコンテントイメージングシステムのような先進的なConfocalイメージングは、マルチチャンネル高輝度レーザー光源を利用し、アッセイ感度を高め、露光時間を最小限に抑えます。
最後に、オルガノイドを画像化する際、解像度を犠牲にすることなく、さまざまなレベルの詳細を捉えるためには、確実な焦点合わせが極めて重要です。さらに、共焦点ハイコンテントイメージングとロバスト性画像解析ソフトウェアを組み合わせることで、研究者は、サイズ、面積、体積、密度、細胞間距離、細胞内構造を含む包括的な表現型プロファイルを作成することができます。
画像解析段階におけるもう一つの重要な課題は、オルガノイドの対物レンズと表現型の複雑さと不均一性であり、これが解析の課題となっています。解析手法は、体積、面積、強度を含む複数の読み取り値を用いた対物レンズの特性評価を可能にし、またオルガノイド内の細胞や細胞内構造のカウントや特性評価も可能にします。機械学習要素を含む高度な解析ツールは、オルガノイドの表現型や、様々な治療の結果としての表現型の変化に関する情報を導き出すこともできます。
オルガノイド開発とイメージングの未来
オルガノイド・プロトコルの開発スピードとイメージング技術の進歩に伴い、オルガノイド研究における次の重要なステップは、ワークフローのスピードを改善し、再現性を高めるために、ラボにオートメーションワークフローを組み込むことです。Oksanaによれば、エンドツーエンド自動ワークフローソリューションはまだ発展途上です。
"私達は以前、イメージングと画像解析の自動化に焦点を当てましたが、次のステップはワークフロー全体を自動化する能力です。これは、自動リキッドハンドラー、インキュベーター、遠心分離機、プレートリーダーなど、セルジャーニー全体のあらゆる部分をオートメーション化することを含み、各コンポーネント間をシームレスにナビゲートできるロボットシステムによって結びつけられます。ロボットアームは、培地添加、細胞プレーティング、染色のために、プレートをインキュベーターからリキッドハンドラーに移動させることができます。その後、ハイコンテントイメージングシステムとハイコンテント分析ソフトウェアにプレートを移動させることができます」。
このようなオートメーションシステムの例として、モレキュラーデバイスが構築したオルガノイドイノベーションセンターがあります。これは、細胞培養、処理、インキュベーションからイメージング、分析、データ処理まで、オルガノイド開発プロセスを標準化するエンドツーエンドソリューションです。
オートメーションの他に、初期最適化もオルガノイド研究の成功を決めるもう一つの要因です。Hilaryは言う: 「特異なオルガノイドタイプの生物学的構造とを理解することによって、オルガノイド研究プロセスの最適化に時間をかければかけるほど、データ収集と解析はロバスト性を増し、画像関連データはより質の高いものになります」
特異なオルガノイドタイプの生物学的構造とを理解することで、オルガノイド研究プロセスを前もって最適化することに多くの時間を費やせば費やすほど、データ収集と解析はよりロバスト性となり、画像関連データはより質の高いものとなります。
創薬研究や疾患モデリングに関して言えば、オルガノイド研究は急成長しており、多くの可能性を秘めています。研究室のオプションを検討する際には、再現性があり、信頼性が高く、正確な結果をもたらす合理的なワークフローを開発するために、適切な調査とリソースを投資することが重要です。最適な方法で行うことで、研究者は生産性の向上、効率の改善、市場投入までの時間の短縮、そして最も重要なことですが、患者の生活の質の向上という恩恵を受けることができます。
3Dバイオロジーやオルガノイドのワークフローを合理化するために、弊社がどのようなお手伝いができるか、今すぐ弊社のエキスパートにお問い合わせください。
- Mullard, Asher. "Parsing clinical success rates." Nature Reviews Drug Discovery 15.7 (2016): 447-448.