2024/6/19
がん研究におけるハイスループット薬物スクリーニングの
合理化に向けたマイクロプレートアッセイの利用
がん研究におけるハイスループットスクリーニング
ハイスループットスクリーニング(HTS)は、抗がん剤としての可能性を持つ化合物を迅速かつ体系的に評価することを可能にし、がん研究分野に革命をもたらしました。このアプローチは、がん創薬の初期段階における極めて重要なステップです。
HTSでは、ライブラリから数千から数百万の化合物を系統的に評価し、予測通りに特定の生物学的標的と相互作用する可能性のある候補物質を特定します。 これらの候補物質は、しばしば「リード」または「ヒット」と呼ばれ、抗がん剤のさらなる最適化と開発の基礎となります。
さらに、近年のがん個別化治療の進歩は、標的薬の開発によってもたらされました。これらの治療は、一次組織の多くの特性を模倣しながら自己複製能、自己組織化、長期増殖能力を持つオルガノイドの培養を含むオルガノイド技術の革新を活用することができます PDOは多用途であり、シーケンシング分析、薬剤スクリーニング、標的療法試験、腫瘍微小環境研究、遺伝子エンジニアリング用途にも利用できます。
HTSアッセイでは、データ収集と解析にマイクロプレートリーダーがよく使用されます。 これらのプレートリーダーは、複数のサンプルの測定を可能にし、スクリーニングプロセスを効率化し、さまざまな生物学的活性の評価を可能にするため、HTSの文脈では不可欠です。 マイクロプレートリーダーは、蛍光、吸光、発光、生存率の変化を特定するラベル、バイオマーカー、さらには酵素活性を特定するラベルなど、特定のアッセイフォーマットに応じて、幅広い生物学的パラメーターを定量的に測定することができます。
がん研究の分野では、これらのインストゥルメンテーションは一般的に、化合物のがん細胞株への影響の評価、特定の遺伝子やタンパク質の表現の研究、およびさまざまな細胞反応の評価に用いられています。 これらのインストゥルメンテーションは、大規模かつ系統的なスクリーニングの取り組みを通じて、潜在的な抗がん剤の特定やがん生物学の理解の促進において重要な役割を果たしています。
ロボット工学とリキッドハンドリング装置は、ハイスループットスクリーニングの自動化に不可欠です。これらの技術により、化合物、細胞、試薬をマルチウェルプレートに正確に分注することが可能となり、一貫性を確保し、ヒューマンエラーを最小限に抑えることができます。
特殊なマイクロプレートリーダーソフトウェアは、データ処理、分析、インストゥルメンテーション制御において重要な役割を果たします。 研究者は、このソフトウェアを使用することで、大量のデータを効率的に管理し、意味のある情報を抽出し、リード化合物に関する情報に基づいた決定を行うことができます。
まとめると、マイクロプレートリーダー、3Dバイオロジー、ロボット工学、リキッドハンドリング装置、専用ソフトウェアの統合により、潜在的な抗がん化合物の発見が加速され、がん研究に革命をもたらしました。HTSは創薬プロセスのすべてを代替するものではありませんが、リード化合物の特定において重要な役割を果たし、がん生物学の理解を深めるのに役立っています。
がん研究のためのマイクロプレート・アッセイ
マイクロプレートアッセイは、ハイスループット機能と多数のサンプルを同時に分析できる機能を備えた貴重なツールとして登場しました。このアッセイにより、細胞生存率や細胞毒性からタンパク質間相互作用や酵素活性まで、がん生物学のさまざまな側面を研究者が調査することが可能になります。本記事では、がん研究で使用される主なマイクロプレートアッセイをいくつか紹介します。
細胞生存率アッセイ
細胞生存率アッセイは、サンプル中の生存細胞および増殖細胞の数を測定するために使用されます。 これは、がん細胞に対するさまざまな治療の影響を評価する上で不可欠であり、研究者が抗がん剤の潜在能力を評価するのに役立ちます。 一般的な方法としては、生細胞に取り込まれる色素を使用し、その結果生じるシグナルをマイクロプレートリーダーで測定する方法があります。
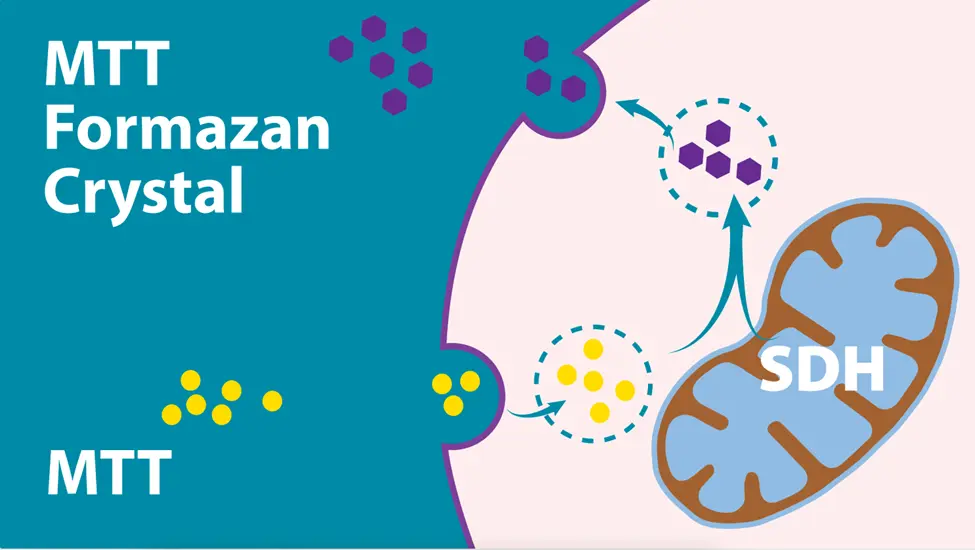
・MTT(3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロマイド)アッセイは、主に研究において、比色分析による細胞生存率と増殖の評価に用いられています。黄色のMTT色素は代謝活性のある細胞によって還元され、紫色のホルマザン生成物を形成します(図1)。これは可溶化され、マイクロプレートリーダーで590nmの吸光度を測定します。MTT は非常に安価で、4 時間以内に結果が得られるため比較的迅速です。市場には、同様の方法で機能する他のマイクロプレートアッセイもあります。例えば、黄色の XTT(2,3-ビス-(2-メトキシ-4-ニトロ-5-スルホフェニル)-2H-テトラゾリウム-5-カルボキサニリド)は、 代謝活性のある細胞によってオレンジ色のホルマザン(吸光度測定、OD 450-500 nm)に還元されるか、またはレザスリン染料(alamarBlue)がレゾルフィン(蛍光測定、ex 560 / em 590)に還元されます。
アプリケーションノートを読む:比色分析による細胞生存率と増殖の評価
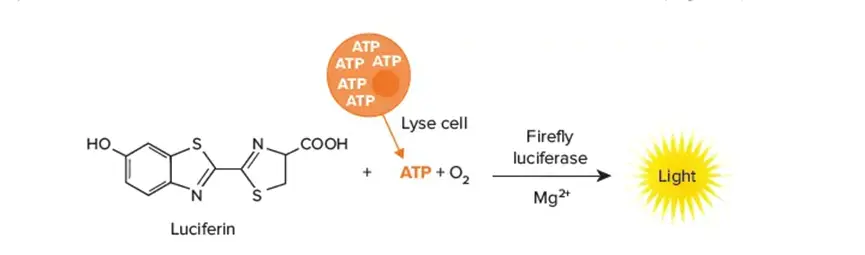
・ATP(アデノシン三リン酸)アッセイは、培養中の生存率細胞数を測定するためのホモジニアスで安定した発光アッセイです。この方法は、代謝的に活性な細胞の指標となるウェル内のATPの定量化に基づいています(図2)。いくつかの企業が、サンプルが入ったウェルに1:1の割合で添加するだけで使用できる化合物を販売しており、短いインキュベーションの後、発光検出モードを備えたマイクロプレートリーダーでサンプルを読み取ることができます。前述の通り、がん研究ではいくつかの試験が3Dモデルで実施されています。スフェロイドの生存率アッセイを実施するのは、試薬がスフェロイドの中心部に確実に到達させるのが難しいことから、困難な場合があります。しかし、3D培養に特異的なATPベースの生存率アッセイが現在利用可能となっており、2Dおよび3Dモデルシステムの両方で、薬剤反応を迅速に評価することが容易になりました。
ATPアッセイの詳細:
・均質で安定性の高い発光アッセイを用いたがん細胞の生存率評価
・発光生存率アッセイで2Dおよび3D乳癌モデルシステムにおける薬剤反応を迅速に評価
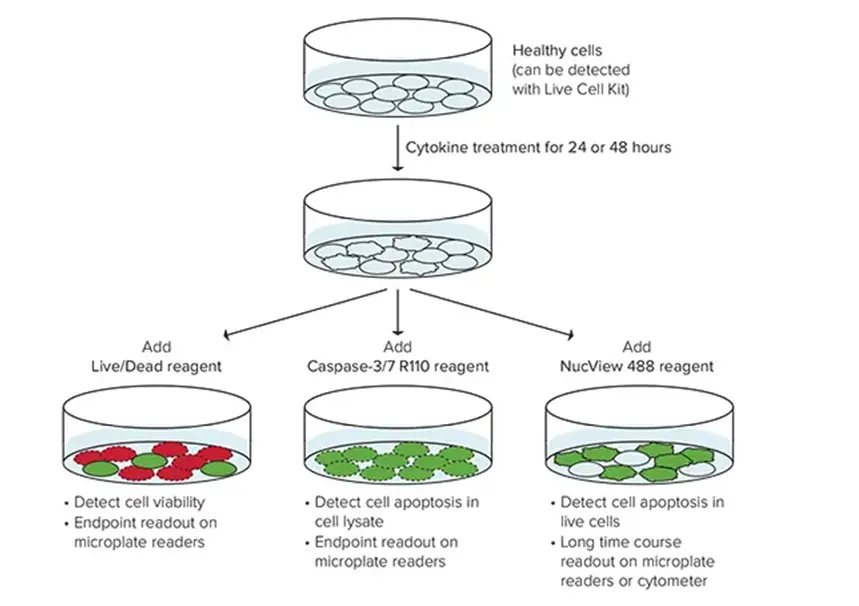
・モレキュラーデバイスのEarlyTox™ Live/Dead アッセイには、生細胞または死細胞を検出するための2つのマーカー、カルセインAMとエチジウムホモダイマー-III(EthD-III)が含まれています。非蛍光性のカルセインAMは、無傷の細胞膜を透過し、生細胞内のエステラーゼによって蛍光性のカルセインに変換されます。EthD-IIIは非蛍光性で、無傷の細胞膜を透過しません。細胞膜の完全性が損なわれると(細胞死)、EthD-III が細胞内に入り、核酸と結合し、死細胞に明るい赤色の蛍光を発します(図4)
アプリケーションノートを読む:SpectraMax® iD3 リーダーでの細胞生存率アッセイによる細胞の健康状態の測定
細胞毒性アッセイ
癌研究では、潜在的な抗癌剤を含む様々な治療に対する細胞の反応を理解することが重要です。これらのマイクロプレートアッセイは、研究者がアポトーシス(プログラム細胞死)とネクローシス(制御不能な細胞死)のプロセスを区別するのに役立ちます。
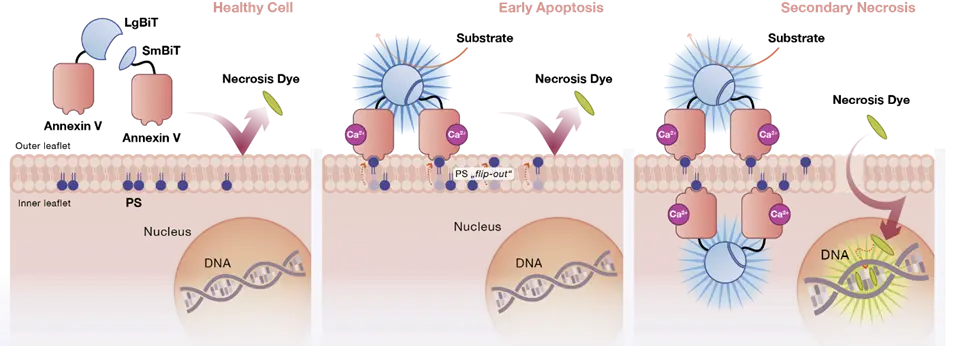
・アポトーシスやネクローシスを含む、さまざまな細胞死プロセスを検出および測定するために、さまざまなアッセイが設計されています。プロメガ社のアッセイでは、アポトーシス過程において、NanoBiT®ルシフェラーゼの相補的サブユニットを含む2つのアネキシンV融合タンパク質が細胞膜の外層で露出したホスファチジルセリンに結合することで、発光シグナルが生成されます。 膜の完全性が失われると、DNA結合色素が細胞内に入り、緑色蛍光シグナルを生成します(図3)。
・LDH(乳酸脱水素酵素)アッセイでは、死滅または死にかけている細胞のように細胞膜が破壊された場合、LDHが細胞培養液中に放出されます。
・カスパーゼ活性は、活性なカスパーゼによる切断時に蛍光を発する蛍光性基質を用いて測定されます。例えば、EarlyTox Caspase-3/7 R110 Assayは、マイクロプレートリーダー用に特別に設計された、単一ステップのホモジニアスアッセイです。蛍光性基質(Ac-DEVD)2-R110は、2つのDEVDコンセンサス配列を含み、2段階の酵素反応により細胞溶解液中で完全に加水分解されます。 両方のDEVDペプチドが加水分解されると、緑色蛍光色素ローダミン110(R110)が遊離し、490nmのExcitationで励起され、520nmでEmissionされることで、蛍光が大幅に増加します(図4)。同様に、The EarlyTox Caspase-3/7 NucView™ 488 Assay は、NucView 488 Caspase-3 基質を使用することで、無傷の細胞集団におけるアポトーシスの検出を可能にします。このマイクロプレートアッセイの利点は、マイクロプレートリーダーとイメージングシステムの両方で使用できるように最適化されていることです。このアッセイキットは、SpectraMaxマイクロプレートリーダーまたはSpectraMax MiniMax 300イメージングサイトメーターと併用することで、アポトーシスの定量化に柔軟なアプローチを提供します。アポトーシス細胞は、ウェルあたりの総蛍光の関数として直接測定することも、個々の細胞をイメージングしてカウントすることもでき、いずれの方法でも同等の結果が得られます。最後に、EarlyTox Caspase-3/7 NucView™ 488 アッセイがスフェロイドに対しても非常に有効であることを示しました。具体的には、磁気的にバイオプリンティングしたHepG2スフェロイドにおけるアポトーシスを評価しました(図4)。
レポーター遺伝子アッセイ
このマイクロプレートアッセイでは、特定の遺伝子やシグナル伝達経路の活性をモニターするために、レポーター遺伝子を癌細胞やその他の細胞に導入します。 レポーター遺伝子の発現はマイクロプレートリーダーで定量化でき、癌関連遺伝子や経路の制御に関する洞察が得られます。 最も広く使用されているものの1つに、転写レベルでの遺伝子発現の研究を可能にするルシフェラーゼレポーターアッセイがあります。 比較的安価で迅速かつ定量的な測定が可能であるため、広く普及しています。ホタルルシフェラーゼは、遺伝子制御と機能の研究に広く使用されているレポーターです。 哺乳類のセルや組織には内因性のルシフェラーゼ活性が存在しないため、非常に感度の高いレポーターです。ホタルルシフェラーゼは、ATP依存的にD-ルシフェリンを酸化し、その結果として発光します(図1A)。 ウミシイタケ(Renilla reniformis)由来のルシフェラーゼは、トランスフェクション効率の標準化や遺伝子制御および機能の研究のための第2のレポーターとして、マルチプレックスルシフェラーゼアッセイで頻繁に使用されます。 レニラルシフェラーゼは、酸素によりセレンテラジンを酸化し、発光します(図1B)。デュアル・ルシフェラーゼアッセイでは、ホタルとレニラの両方のルシフェラーゼ活性を1つのサンプルで測定することができ、ホタルが実験用レポーター、レニラがコントロールとして機能します(図5)。
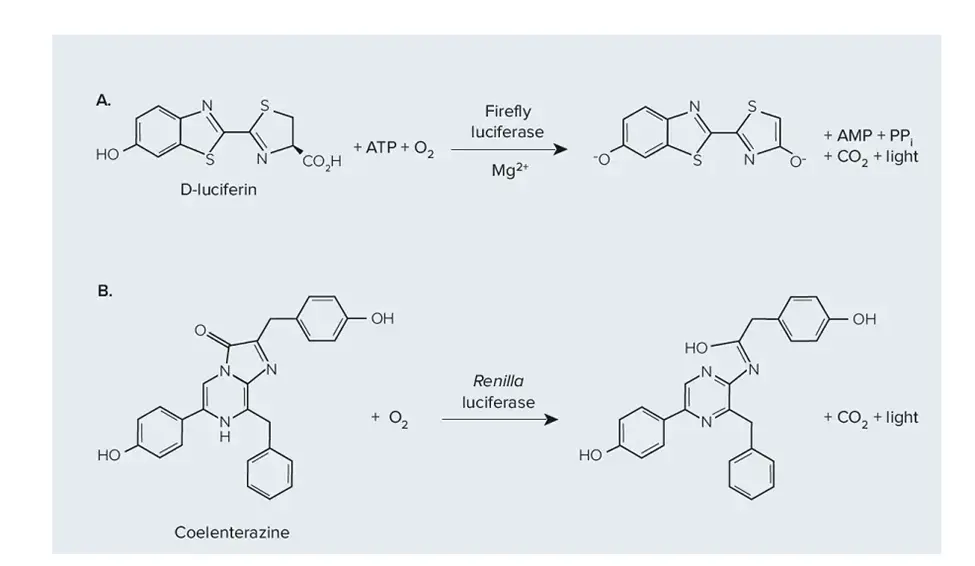
The SpectraMax DuoLuc™ Reporter Assay Kitは、哺乳類細胞におけるホタルおよびRenillaルシフェラーゼの両方を高感度で定量することを可能にします。 2種類の最適化された検出試薬を連続的に注入することで、同じマイクロプレートウェル内でルシフェラーゼをアッセイすることができます。 例えば、DuoLucレポーターアッセイとSpectraMax iD5®マルチモードマイクロプレートリーダーを組み合わせて、哺乳類細胞モデルにおける核因子-κB(NF-κB)の活性化を検出する方法をご紹介しています。NF-κBは、炎症、免疫、増殖、分化、アポトーシスの制御に非常に重要な役割を果たしています。
DuoLucレポーターアッセイの詳細については、こちらをご覧ください。
SpectraMax iD5の高感度デュアルルシフェラーゼレポーターアッセイでNF-κB活性化をモニタリング
SpectraMax Miniマルチモードマイクロプレートリーダーでデュアルルシフェラーゼレポーター遺伝子活性を測定
酵素活性アッセイ
キナーゼやホスファターゼなどの酵素は、癌のシグナル伝達経路において重要な役割を果たしています。酵素活性アッセイでは、検出可能なシグナルを生成する基質を使用して、これらの酵素の活性を測定します。マイクロプレートリーダーは酵素反応を定量化し、研究者らは異なる治療法が酵素活性に与える影響を評価することができます。
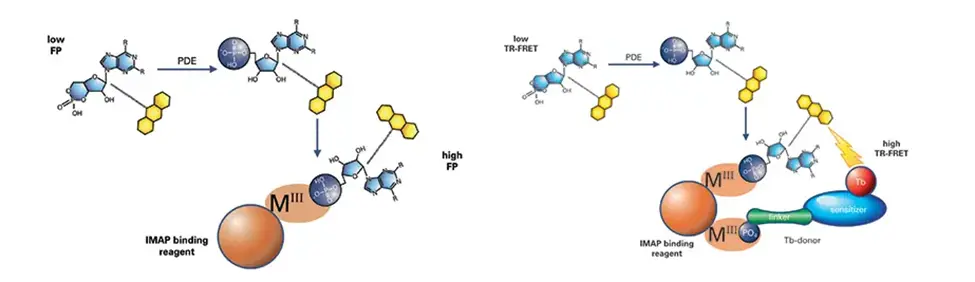
・モレキュラーデバイスの IMAP® テクノロジーは、キナーゼ、ホスファターゼ、およびホスホジエステラーゼの迅速かつ均一な非放射性アッセイを可能にします(図7)。このテクノロジーはアッセイ開発とハイスループットスクリーニングの両方に適しています。IMAPアッセイは、リン酸基とナノ粒子上の固定化金属配位複合体の結合に基づいています。IMAP結合体がリン酸化基質に結合すると、ペプチドの分子運動が変化し、ペプチドに結合した蛍光標識の蛍光偏光(FP)が増加します(図6、左)。TR-FRETバージョンのアッセイでは、テルビウム(Tb)供与体の添加により、リン酸化基質が存在すると蛍光エネルギー移動が起こります(図x、右)。このマイクロプレートアッセイは時間分解蛍光モードで検出され、スクリーニング中のアッセイ成分や化合物による蛍光干渉を事実上排除します。TR-FRETは基質のサイズや濃度にも柔軟に対応できます。
IMAPアッセイについてさらに詳しく知る:
SpectraMax M5マルチモードマイクロプレートリーダーでのIMAP FPキナーゼアッセイ
SpectraMaxマルチモードマイクロプレートリーダーでのIMAPホスホジエステラーゼアッセイ
・THUNDER™ は、Bioauxilium Research 社が開発した、多用途で費用対効果の高い細胞ベースアッセイプラットフォームであり、個々のリン酸化および総内因性タンパク質を測定します。具体的には、THUNDER™ Phospho-ERK1/2 (T202/Y204) アッセイキットは、MAPK/ERK細胞シグナリング経路の上流に位置するチロシンキナーゼ受容体の活性の高低を間接的に報告できる、3ステップのシンプルなワークフローによるホモジニアスTR-FRETサンドイッチイムノアッセイです(図8)。
アプリケーションノートを読む:THUNDER TR-FRETアッセイによるERK1/2リン酸化のセルベース測定
タンパク質間相互作用アッセイ
研究者はマイクロプレートリーダーを使用して、がん経路における特定のタンパク質間の相互作用を検出および定量化します。これらの相互作用は、がんの発生と進行におけるこれらのタンパク質の役割を明らかにすることができます。薬物治療は、特定のタンパク質間相互作用を妨害することを目的として設計されることがよくあります。そのため、特定のタンパク質間の相互作用の研究を促進するマイクロプレートアッセイが重要となります。
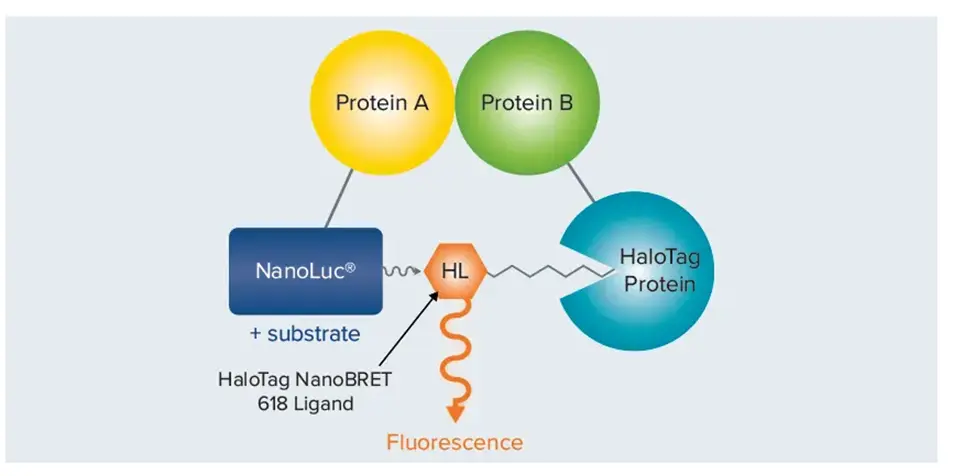
・BRET(生体発光共鳴エネルギー転移)は、発光ドナーと蛍光アクセプターを利用したタンパク質間またはタンパク質-リガンド間の相互作用を測定する技術です。ドナーとアクセプターが10nm以内に近づくと、ドナーがアクセプターをExcitationし、アクセプターが蛍光を発します。 対象となるタンパク質にドナーを、その結合パートナーにアクセプターをタグ付けすることで、マイクロプレートリーダーを使用してドナーとアクセプター(図9)から発せられる光を検出することで、タンパク質間相互作用を測定することができます。
NanoBRET技術についてさらに詳しく知る:
NanoBRET技術によるp53-MDM2タンパク質間相互作用の測定
SpectraMax i3x マルチモードマイクロプレートリーダーに搭載されたNanoBRETテクノロジー
NanoBRET™技術に対応したプレートリーダーの性能評価:シンプルで効果的な2つのアッセイ
・TR-FRETアッセイは、タンパク質間相互作用、核内受容体アッセイ、受容体の二量体化、リガンド結合、受容体の細胞内移行、酵素アッセイなど、さまざまな課題に対応しています。 ドナーとアクセプターという2種類の蛍光体を使用して、標的タンパク質やその他の生体分子を標識します。 2つの生体分子が近接すると、ドナー蛍光体からアクセプター蛍光体への蛍光共鳴エネルギー移動(FRET)が起こります。TR-FRETでは、化合物やその他の物質からの短寿命のバックグラウンド蛍光を最小限に抑えるため、長寿命の蛍光ランタニドクリプテートを供与体として使用します。 マイクロプレートリーダーによる時間分解蛍光共鳴エネルギー移動(TR-FRET)の検出により、生体分子の結合が読み取られます。(上記IMAP TR-FRETも参照)
・蛍光偏光(FP)は、溶液中の結合イベントのモニタリングに広く使用されています。 タンパク質と抗体の結合、DNAハイブリダイゼーション、酵素活性の評価に使用でき、ハイスループットスクリーニングにも適しています。 小さな蛍光標識分子(トレーサー)は、平面偏光で励起されると、主に偏光解消光を発します。これは、励起と発光の間の時間内にトレーサーが急速に回転するためです。しかし、トレーサーがはるかに大きな分子と結合すると、回転が遅くなり、放出される光はほとんど偏光したままになります。 偏光/偏光解消光の量は、タンパク質とトレーサー間の相互作用の定量化に役立ちます。(上記のIMAP FPも参照してください。)
アプリケーションノートを読む:蛍光偏光アッセイの確立と最適化
ELISA(酵素結合免疫吸着測定法)
ELISAは、癌研究におけるタンパク質の定量に広く使用されています。 マイクロプレートリーダーは、これらのアッセイで生成されたシグナルを測定し、サイトカインや成長因子などの特定のタンパク質の濃度を決定します。これらのタンパク質は、癌生物学と関連していることがよくあります。 ELISAの詳細については、当社の電子書籍『ELISAの基礎から実用まで』をダウンロードしてください。
AlphaScreen & AlphaLISA
AlphaLisaは、マイクロプレートフォーマットで分子間相互作用を研究するためのビーズベースのホモジニアスアッセイです。 従来のELISA法では、細胞単層を損傷する可能性のある洗浄ステップが複数あり、また非常に時間がかかるのに対し、AlphaLISAでは洗浄ステップが不要であるため、セルロスを最小限に抑え、より迅速かつ正確な結果が得られます。
アプリケーションノートを読む:SpectraMax ParadigmマルチモードマイクロプレートリーダーでのAlphaLISA Screen
TR-FRET(HTRFを含む)
HTRFは、生体分子の相互作用を検出するために開発された多用途の技術です。蛍光共鳴エネルギー移動(FRET)技術と時間分解(TR)蛍光測定を組み合わせることで、短寿命のバックグラウンド蛍光を排除することができます。
アプリケーションノートを読む:SpectraMax Paradigmマルチモードマイクロプレートリーダーを用いたHTRFヒトTNFαアッセイ
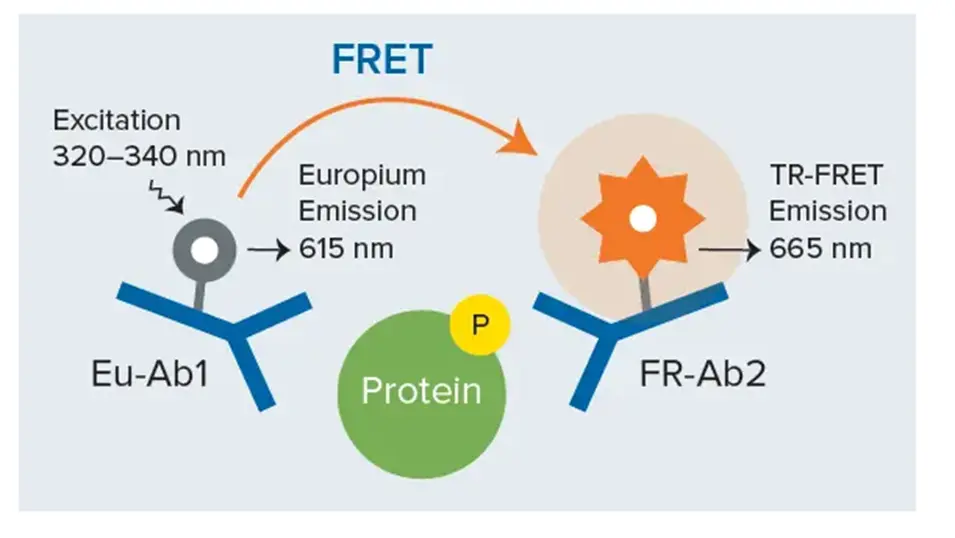
このアッセイでは、ドナー蛍光体とアクセプター蛍光体が使用されます。ドナーとアクセプターが十分に接近している場合、エネルギー源(フラッシュランプなど)によるドナーの励起がアクセプターへのエネルギー移動を引き起こし、アクセプターが特定の蛍光を所定の波長で放出します。HTRFは、2時間という短い時間でタンパク質の検出と定量化を可能にするシンプルなノーウォッシュ戦略を提供するため、従来のELISAに代わる手法としても広く使用されています。さらに、幅広い検出範囲を持ち、長時間の信号安定性を備え、拡張性にも優れています。
アプリケーションノートを読む:HTRFサイトカインアッセイの結果を細胞生存率に正規化するワークフロー
活性酸素種(ROS)アッセイ
活性酸素種は酸化ストレスや癌の発生と関連しています。 マイクロプレートリーダーは活性酸素種のレベルを定量化できるため、研究者は癌細胞の酸化状態やそれが癌の進行にどのように寄与するかを理解することができます。
アプリケーションノートを読む:SpectraMaxマイクロプレートリーダーによる活性酸素種の測定
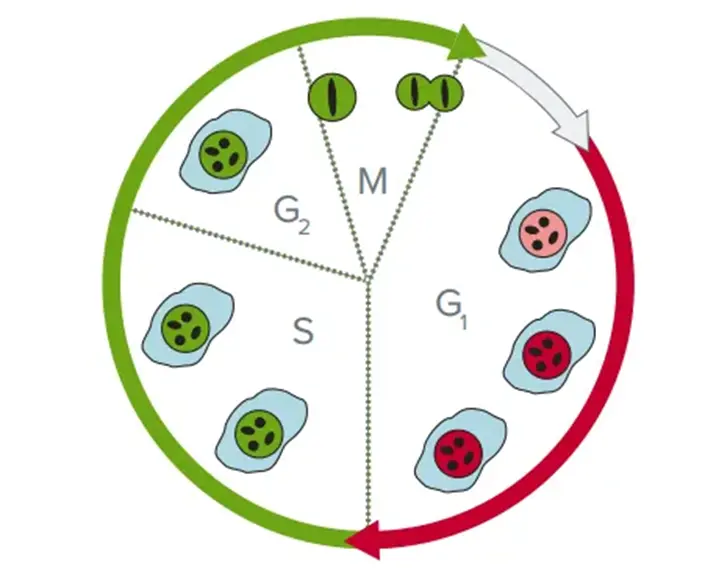
セルサイクル分析
セルサイクル分析は、がん研究においてしばしば必要となる重要な研究です。通常、フローサイトメトリーによって行われます。しかし、SpectraMax® MiniMax™ 300 イメージングサイトメーターを搭載した SpectraMax® i3x マルチモードマイクロプレートリーダーは、FUCCI(蛍光ユビキチン化に基づく細胞周期インジケーター)スフェロイドの画像取得と画像分析に使用できます。FUCCIスフェロイドは、細胞周期のさまざまな段階にある細胞を識別できるため、がん細胞の細胞周期の進行を研究するために開発されました。FUCCI技術は、2つの修飾された細胞周期依存性タンパク質、ジェミニンとCdt1の過剰発現に基づいています。それぞれ緑色蛍光タンパク質(ジェミニンにはAmCyan、Cdt1にはmCherry)と融合しています。Cdt1とジェミニンのレベルは、細胞周期を通じて異なる変動を示します。Cdt1レベルはG1期にピークに達し、一方、ジェミニンレベルはS期後期、G2期、M期に上昇します。この結果、FUCCIを発現する細胞の核は、G1期には赤色に、S後期、G2期、M期には緑色に発色します(図10)。このアッセイはHTSスクリーニングには適していませんが、化合物のリードが選択され、さらに詳細な特性評価を行う際に実施できる重要なマイクロプレートアッセイです。
アプリケーションノートを読む:FSpectraMax MiniMaxサイトメーターでFUCCIスフェロイドの画像を取得し、解析
がん研究におけるマイクロプレートリーダーの潜在能力を解き放ちましょう。
がんの分子および細胞レベルでの基礎に関する理解は大きく進歩しましたが、その原因、進行、潜在的な治療法については、まだ学ぶべきことが多く残されています。
この電子書籍は、がんの研究と開発におけるマイクロプレートリーダーの役割について、洞察に満ちた包括的な概要を提供することを目的として作成されました。